题目内容
【题目】常温下,分别用 0.01mol/L 的 NaOH 溶液滴定与之等浓度的体积均为 25.00mL 的 HA、H3B(三元酸)溶液,溶液的 pH 随V(NaOH)变化曲线如图所示,下列说法错误的是
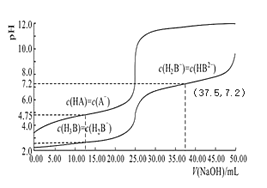
A.常温下 K(HA)数量级约为10-5
B.常温下 0.01mol/L 的 NaH2B溶液的 pH 大于 7
C.NaOH 溶液滴定 HA 溶液应选择酚酞作为指示剂
D.当横坐标为 37.50时,溶液中存在:2c(H+)+c(H2B-)+3c(H3B)=2c(OH-)+3c(B3-)+c(HB2-)
【答案】B
【解析】
A.c(HA)=c(A-) 时,K(HA)=![]() =10-4.75,常温下 K(HA)数量级约为10-5,故A正确;
=10-4.75,常温下 K(HA)数量级约为10-5,故A正确;
B.当c(H2B-)=c(H3B)时,Ka1=c(H+)=10-2.5,c(H2B-)=c(HB2-)时,Ka2=c(H+)=10-7.2,HB2-的电离程度更小,则Ka3<10-7.2,H2B-的水解平衡常数Kh=![]() =10-11.5<Ka2=10-7.2,说明H2B-的水解程度小于电离程度,常温下 0.01mol/L 的 NaH2B溶液的 pH 小于 7,故B错误;
=10-11.5<Ka2=10-7.2,说明H2B-的水解程度小于电离程度,常温下 0.01mol/L 的 NaH2B溶液的 pH 小于 7,故B错误;
C.滴定终点溶液呈碱性,NaOH 溶液滴定 HA 溶液应选择酚酞作为指示剂,故C正确;
D.当横坐标为 37.50时,溶液为Na2HB、NaH2B等物质的量混合物,溶液中存在电荷守恒①c(H+)+c(Na+)=3c(B3-)+2c(HB2-)+c(H2B-)+c(OH-),物料守恒:②2c(Na+)=3c(H3B)+3c(H2B-)+3c(HB2-)+3c(B3-),将①×2-②,得2c(H+)+c(H2B-)+3c(H3B)=2c(OH-)+3c(B3-)+c(HB2-),故D正确;
故选B。

【题目】下列实验现象描述正确的是( )
选项 | 实 验 | 现 象 |
A | 向氢氧化钠溶液中滴加FeCl3饱和溶液 | 有氢氧化铁胶体产生 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝滴落下来 |
C | 向滴有酚酞的溶液中加入足量Na2O2粉末 | 溶液变红 |
D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮 |
A.AB.BC.CD.D
【题目】钙钛矿(主要成分是CaTiO3)太阳能薄膜电池制备工艺简单、成本低、效率高,引起了科研工作者的广泛关注,科学家认为钙钛矿太阳能电池将取代硅基太阳能电池的统治地位。
(1)基态Ti原子的价电子排布式为__,能量最高的能级有__个空轨道;Si、P、S第一电离能由小到大顺序是__。
(2)碳和硅的有关化学键键能如表所示:
化学键 | CC | CH | CO | SiSi | SiH | SiO |
键能/kJmol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是___。
(3)一种新型熔融盐燃料电池以Li2CO3和Na2CO3的熔融盐混合物作电解质,则CO32-的空间构型为___。
(4)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:
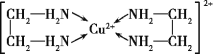
该配离子中含有的化学键类型有__(填字母)。
a.配位键 b.极性键 c.离子键 d.非极性键
一个乙二胺分子中共有__个σ键,C原子的杂化方式为__。
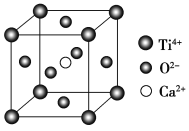
(5)CaTiO3的晶胞为立方晶胞,结构如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角)Ca2+的配位数为__,与Ti4+距离最近且相等的O2-有__个;晶体的密度为ρg/cm3,最近的Ti4+和O2-之间的距离为__nm(填计算式)。(CaTiO3的摩尔质量为136g/mol,NA为阿伏加德罗常数)。
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
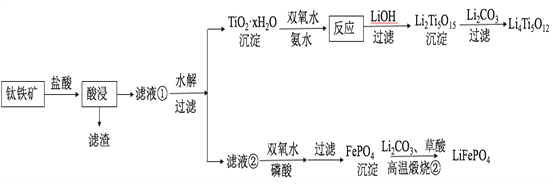
回答下列问题:
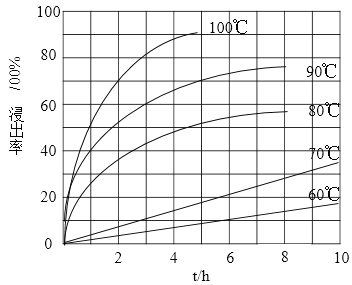
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。