题目内容
【题目】CO、H2 是重要的工业原料,在高温、催化剂存在的条件下,可用甲烷 和水蒸气为原料制取它:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH0
CO(g)+3H2(g) ΔH0
(1)已知:
① 2H2(g)+O2(g)=2H2O(g) ΔH1=-484kJ·mol-1
② CH4(g)+1.5O2(g)=CO(g)+2H2O(g) ΔH2=-564kJ·mol-1。
则ΔH0 =_____。
(2)一定温度下,将一定量甲烷与水蒸气的混合气体置于某密闭容器中发生反应 生成 CO、H2,测得反应体系中平衡时的某种量值 X 与温度(T)、压强(P)之间的关系如图 所示:
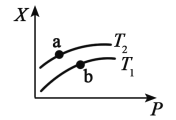
若 X 表示 CH4 的百分含量,则 T1_________T2(填“>”“<”“无法确定”,下同),X 还可 以表示_____(在下列选项中选填序号),a、b 两点的平衡常数 K(a) ____K(b)。
A.混合气体的平均摩尔质量 B.CO 的产率 C.ΔH 值
(3)若在 T3 时将 4mol H2O(g)与 a mol CH4 置于 2L 恒容密闭容器中,测得 CO 的 浓度(mol/L)与时间 t(min)的关系如图 所示。
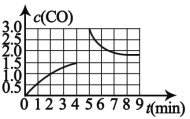
①反应 4min 后达平衡, 反应 4min 内用 H2浓度变化表示的反应速率 v(H2)=__________________
②若在第 5 分钟时改变条件,CO 浓度变化曲线如图 所示,则改变条件可能是____________
(4)从焓变角度上看,反应 CO2(g)+H2O(g)=CO(g)+H2(g)+O2(g)_____(填“具 有”或“不具有”)自发性。
【答案】+162 kJ/mol > A < 1.125mol/(L·min) 增加CO的量 不具有
【解析】
(1)根据盖斯定律计算CH4(g)+H2O(g)![]() CO(g)+3H2(g)的焓变;
CO(g)+3H2(g)的焓变;
(2)CH4(g)+H2O(g)![]() CO(g)+3H2(g),正反应吸热,升高温度平衡正向移动,CH4(g)的百分含量降低;正反应气体系数和增大,增大压强平衡逆向移动。
CO(g)+3H2(g),正反应吸热,升高温度平衡正向移动,CH4(g)的百分含量降低;正反应气体系数和增大,增大压强平衡逆向移动。
(3)①根据![]() 计算反应速率;
计算反应速率;
②由图象可知,反应 4min 后达平衡,若在第 5 分钟时改变条件,CO 浓度先突然增大后逐渐减小;
(4)吸热反应不易发生;
(1) ① 2H2(g)+O2(g)=2H2O(g) ΔH1=-484kJ·mol-1
② CH4(g)+1.5O2(g)=CO(g)+2H2O(g) ΔH2=-564kJ·mol-1。
根据盖斯定律②-①×![]() 得CH4(g)+H2O(g)
得CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH0 =-564kJ·mol-1-(-484kJ·mol-1)×
CO(g)+3H2(g) ΔH0 =-564kJ·mol-1-(-484kJ·mol-1)×![]() =+162 kJ/mol。
=+162 kJ/mol。
(2)CH4(g)+H2O(g)![]() CO(g)+3H2(g),正反应吸热,升高温度平衡正向移动,温度越高CH4(g)的百分含量越低,所以T1>T2;
CO(g)+3H2(g),正反应吸热,升高温度平衡正向移动,温度越高CH4(g)的百分含量越低,所以T1>T2;
A.增大压强,平衡逆向移动,混合气体的平均摩尔质量增大,所以X 还可以表示混合气体的平均摩尔质量;
B.增大压强,平衡逆向移动,CO 的产率降低,所以X不能表示CO 的产率;
C.ΔH只与热化学方程式的系数有关,增大压强ΔH值不变,所以X不能表示ΔH值;故选A;
平衡常数只与温度有关,CH4(g)+H2O(g)![]() CO(g)+3H2(g),正反应吸热,升高温度平衡正向移动,平衡常数增大,T1>T2,所以K(a) <K(b);
CO(g)+3H2(g),正反应吸热,升高温度平衡正向移动,平衡常数增大,T1>T2,所以K(a) <K(b);
(3)①反应 4min 内CO的浓度变化量为1.5mol/L,所以H2浓度变化量为4.5mol/L, ![]() 1.125mol/(L·min);
1.125mol/(L·min);
②由图象可知,反应 4min 后达平衡,若在第 5 分钟时改变条件,CO 浓度先突然增大后逐渐减小,则改变条件可能是增加CO的量;
(4)CO、H2的燃烧放热,所以CO2(g)+H2O(g)=CO(g)+H2(g)+O2(g)正反应吸热,吸热反应不易发生, 所以CO2(g)+H2O(g)=CO(g)+H2(g)+O2(g)不具有自发性。

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】下列“试剂”和“试管中的物质”不能完成“实验目的”的是( )
实验目的 | 试剂 | 试管中的物质 | |
A | 羟基对苯环的活性有影响 | 饱和溴水 | ①苯 ②苯酚溶液 |
B | 甲基对苯环的活性有影响 | 酸性KMnO4溶液 | ①苯 ②甲苯 |
C | 苯分子中没有碳碳双键 | Br2的CCl4溶液 | ①苯 ②己烯 |
D | 碳酸的酸性比苯酚强 | 石蕊溶液 | ①苯酚溶液 ②碳酸溶液 |
A.AB.BC.CD.D