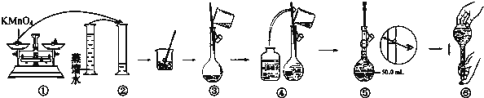
题目内容
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法正确的是(NA为阿伏加德罗常数的值)
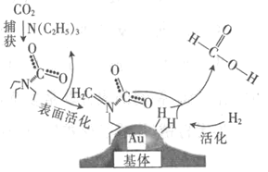
A.标准状况下,22.4 L CO2中所含的电子数目为16NA
B.10.1 g N(C2H5)3中所含的极性共价键数目为2.1NA
C.2 mol Au与2 mol H2中所含的分子数目均为2NA
D.100 g 46%的甲酸水溶液中所含的氧原子数目为5NA
【答案】D
【解析】
A、标准状况下,22.4LCO2的物质的量为1mol,1个CO2分子中含有6+8×2=22个电子,则22.4LCO2含有22mol电子,其电子数目为22 NA,A错误;
B、N(C2H5)3的结构式为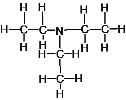 ,所含的化学键中C-N和C-H均为极性共价键,1mol N(C2H5)3中含有18mol极性共价键,10.1g N(C2H5)3,其物质的量为0.1mol,则其含有极性共价键的物质的量为1.8mol,数目为1.8NA,B错误;
,所含的化学键中C-N和C-H均为极性共价键,1mol N(C2H5)3中含有18mol极性共价键,10.1g N(C2H5)3,其物质的量为0.1mol,则其含有极性共价键的物质的量为1.8mol,数目为1.8NA,B错误;
C、Au为金属单质,不含有分子,2molAu中不含有分子,C错误;
D、100 g 46%的甲酸水溶液,则甲酸质量为46g,则其物质的量为1mol,分子中含有2molO原子;水的质量为100g-46g=54g,其物质的量为3mol,则含有3mol O原子,总共含有5mol O原子,其数目为5NA,D正确;
答案选D。

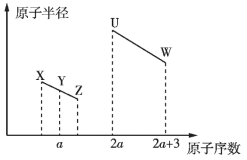
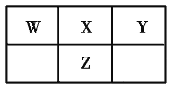
【题目】现有部分短周期元素的相关信息如下表所示:
元素代号 |
|
|
|
|
相关信息 | 海水中质量分数最高的元素 | 其简单氢化物的水溶液呈碱性 |
| 其简单离子是第3周期元素的简单离子中半径最小的 |
(1)![]() 在元素周期表中位于第______周期第______族;元素
在元素周期表中位于第______周期第______族;元素![]() 与元素
与元素![]() 相比,金属性较强的是______(用元素符号表示),下列能证明这一事实的是______(填序号)。
相比,金属性较强的是______(用元素符号表示),下列能证明这一事实的是______(填序号)。
a.![]() 单质的熔点比
单质的熔点比![]() 单质的低
单质的低
b.在化合物中![]() 的化合价比
的化合价比![]() 低
低
c.![]() 的单质能与冷水剧烈反应而
的单质能与冷水剧烈反应而![]() 的单质不能
的单质不能
d.![]() 、
、![]() 同周期且
同周期且![]() 在
在![]() 的右侧
的右侧
(2)![]() 与
与![]() 元素可形成含有共价键的常见二元离子化合物,该化合物的化学式为______,该化合物中离子键与共价键的数目比为______。
元素可形成含有共价键的常见二元离子化合物,该化合物的化学式为______,该化合物中离子键与共价键的数目比为______。
(3)![]() 、
、![]() 的氢化物
的氢化物![]() 、
、![]() 在一定条件下反应可得到一种单质和一种常温下为液体的物质,试写出该反应的化学方程式:__________________________________________。
在一定条件下反应可得到一种单质和一种常温下为液体的物质,试写出该反应的化学方程式:__________________________________________。