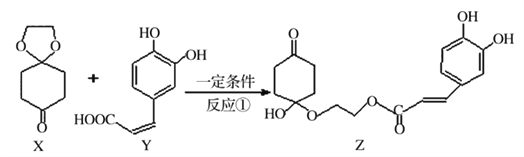
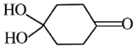
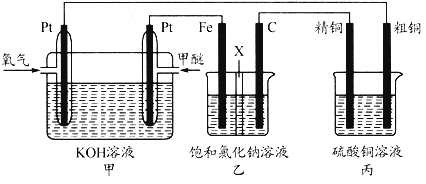
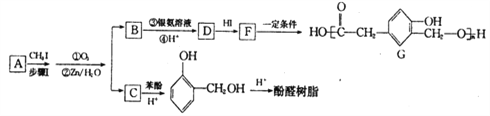
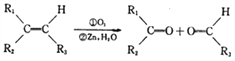
题目内容
【题目】常温下,用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的HX、HY溶液,pH随NaOH溶液体积变化如图。下列结论正确的是

A. 水解常数:X->Y-
B. a、b两点溶液混合后:c(HX)+c(HY)+c(H+)=c(OH-)
C. pH=7时,c(Y-)>c(X-)
D. 10.00mlL时,有c(Na+)>c(HX)>c(X-)>c(H+)
【答案】B
【解析】分析:用浓度为0.1mol/L的NaOH溶液分别逐滴加入到20.00mL0.1mol/L的HX、HY溶液中,酸越弱,初始时刻pH值越大,根据图象可判断,酸性强弱为HY<HX;当NaOH反应了10.00mL时,溶液中分别存在HX-NaX和HY-NaY,且物质的量之比分别为1:1;当NaOH反应了20.00mL时,溶液中分别恰好存在NaX和NaY,二者均会发生水解使溶液呈碱性,根据图象和溶液中的守恒关系解答。
详解:A.对于HX和HY,酸性越弱,电离出的H+浓度越小,初始时刻根据图象,pH越小的酸酸性越强,电离程度就越大,因此酸性强弱为HY<HX,HX电离程度比HY更大,则水解常数X-<Y-,A错误;
B.当V(NaOH)=20.00 mL时,滴定HX的溶液中恰好存在NaX,滴定HY的溶液中恰好存在NaY,二者均水解溶液显碱性,根据质子守恒可知c(HX)+c(HY)+c(H+)=c(OH-),B正确;
C.pH=7时,溶液中c(H+)=c(OH-),根据电荷守恒,分别存在c(Na+)=c(X-),c(Na+)=c(Y-),但HX和HY此时消耗的NaOH的量不相同,前者消耗的多,因此c(X-)>c(Y-),C错误;
D.当V(NaOH)=10.00mL时,滴定HX的溶液中存在HX和NaX,物质的量之比为1:1,此时溶液显酸性,可以判断是酸的电离程度大于酸根离子的水解程度,对于HX-NaX溶液来说,根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(X-),由于溶液是酸性,因此c(H+)>c(OH-),则c(Na+)<c(X-),无论是电离还是水解,都是微弱的过程,因此X-、HX浓度都大于H+的浓度,所以溶液中粒子浓度大小关系为:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),D错误;答案选B。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X,发生反应:pX(g) ![]() Y(g)+Z(g),相关数据如下表所示:
Y(g)+Z(g),相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | 0.160 | 0.160 |
Ⅲ | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器Ⅰ中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器Ⅰ和容器Ⅱ中起始时X的反应速率v(X)Ⅰ___________v(X)Ⅱ(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”),判断理由是___________。
(3)反应方程式中X的化学计量数p的取值为___________,容器Ⅱ中X的平衡转化率为___________。若起始时向容器Ⅰ中充入0.1molX、0.15molY和0.10molZ,则反应将向___________ (填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________。
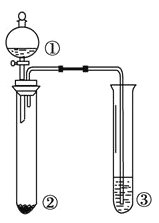
【题目】利用下图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓氯水 | NaBr | 淀粉KI溶液 | 氧化性:Cl2>Br2>I2 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | Br2的苯溶液 | 铁屑 | AgNO3溶液 | 苯与溴单质在铁催化剂作用下 发生取代反应 | |
D | 硝酸 | Na2SO3 | KMnO4溶液 | SO2能使KMnO4溶液褪色 |
A. A B. B C. C D. D