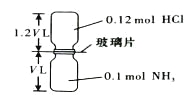
��Ŀ����
����Ŀ��һ���¶����������������Ϊ2.0L�ĺ����ܱ������зֱ����һ������X��������Ӧ��pX(g) ![]() Y(g)+Z(g)������������±���ʾ��
Y(g)+Z(g)������������±���ʾ��
������� | �¶�(��) | ��ʼ���ʵ���(mol) | ƽ�����ʵ���(mol) | |
X(g) | Y(g) | Z(g) | ||
�� | 387 | 0.20 | 0.080 | 0.080 |
�� | 387 | 0.40 | 0.160 | 0.160 |
�� | T | 0.20 | 0.090 | 0.090 |
�ش��������⣺
��1�����������з�Ӧ��10min�ﵽƽ�⣬��ǰ10min��Y��ƽ����Ӧ����v(Y)=___________��������������������ʼʱX�ķ�Ӧ����v(X)��___________v(X)��(������������С��������������)��
��2����֪������ӦΪ���ȷ�Ӧ����T___________387(��������������С����)���ж�������___________��
��3����Ӧ����ʽ��X�Ļ�ѧ������p��ȡֵΪ___________����������X��ƽ��ת����Ϊ___________������ʼʱ���������г���0.1molX��0.15molY��0.10molZ����Ӧ����___________ (����������������)��Ӧ����������ж�������_____________________________________________________��
���𰸡� 0.0040mol/(L��min) С�� С�� �������������������ƽ��������Ӧ�����ƶ����������¶�(������ӦΪ���ȷ�Ӧ��ƽ������ȷ�Ӧ�����ƶ������¶Ƚ���) 2 80% �� ���������������ݿɼ���õ�387���÷�Ӧ��ƽ�ⳣ��Ϊ4��  =1.5<4�����Է�Ӧ������Ӧ�������
=1.5<4�����Է�Ӧ������Ӧ�������
��������������������⿼�黯ѧ��Ӧ���ʺͻ�ѧƽ��ļ��㣬�¶ȡ�ѹǿ�Ի�ѧƽ���Ӱ�죬��ѧƽ�ⳣ����Ӧ�á�
��1������I�Цԣ�Y��=![]() =0.0040mol/��L��min��������I������II�¶���ͬ������II��X����ʼŨ��Ϊ����I�е�����������ʼ��Ӧ��������X��IС�ڦԣ�X��II��
=0.0040mol/��L��min��������I������II�¶���ͬ������II��X����ʼŨ��Ϊ����I�е�����������ʼ��Ӧ��������X��IС�ڦԣ�X��II��
��2���÷�Ӧ������ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ�������I������III�¶Ȳ�ͬ��X��ʼ���ʵ�����ͬ��ƽ��ʱ����III��Y��Z���ʵ�����������I��������III���������Iƽ��������Ӧ�����ƶ�����TС��387��
��3������II������I�¶���ͬ������II��X��ʼ���ʵ���Ϊ����I�е�����������II�൱��������I�����Ͻ������СΪԭ����һ����ƽ��ʱ����II��Y��Z���ʵ���Ϊ����I�е�������������ѹǿ��ƽ�ⲻ�ƶ�����p=1+1=2����Ӧ�ķ���ʽΪ2X��g��![]() Y��g��+Z��g����������II����0.160molY����0.320molX������II��X��ƽ��ת����Ϊ
Y��g��+Z��g����������II����0.160molY����0.320molX������II��X��ƽ��ת����Ϊ![]() 100%=80%������I������0.080molY����0.160molX������Iƽ��ʱX��Y��Z���ʵ�������Ϊ0.04mol��0.08mol��0.08mol��ƽ��ʱX��Y��Z���ʵ���Ũ������Ϊ0.02mol/L��0.04mol/L��0.04mol/L��387��ʱ��Ӧ�Ļ�ѧƽ�ⳣ��K=
100%=80%������I������0.080molY����0.160molX������Iƽ��ʱX��Y��Z���ʵ�������Ϊ0.04mol��0.08mol��0.08mol��ƽ��ʱX��Y��Z���ʵ���Ũ������Ϊ0.02mol/L��0.04mol/L��0.04mol/L��387��ʱ��Ӧ�Ļ�ѧƽ�ⳣ��K=![]() =4����ʱ��Ũ����Ϊ
=4����ʱ��Ũ����Ϊ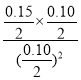 =1.5<4�����Է�Ӧ������Ӧ���������
=1.5<4�����Է�Ӧ������Ӧ���������

 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�����Ŀ����֪X��Y��Z��W��Ϊ��ѧ��ѧ�г����ĵ��ʻ������֮���ת����ϵ��ͼ��ʾ(���ֲ�������ȥ)����W��X��������
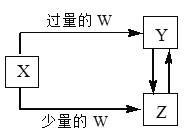
ѡ�� | W | X |
A | ���� | ̼������Һ |
B | ����������Һ | �Ȼ�����Һ |
C | ������̼ | ����������Һ |
D | ���� | ������ |
A. A B. B C. C D. D