题目内容
6.下列化学方程式错误的是( )| A. |  | |
| B. | 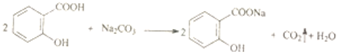 | |
| C. | 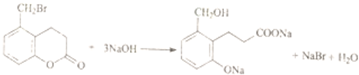 | |
| D. | 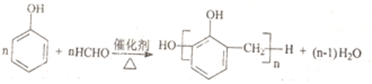 |
分析 A.-COOH、酚-OH均与碳酸钠反应;
B.-COOH的酸性大于酚-OH的酸性,碳酸钠少量时只有-COOH反应;
C.-Br、-COOC-及水解生成的酚-OH均与NaOH反应;
D.苯酚与甲醛在加入浓盐酸作用下发生缩聚反应,生成酚醛树脂.
解答 解:A.-COOH、酚-OH均与碳酸钠反应,反应合理,故A正确;
B.-COOH的酸性大于酚-OH的酸性,碳酸钠少量时只有-COOH反应,反应合理,故B正确;
C.-Br、-COOC-及水解生成的酚-OH均与NaOH反应,反应合理,故C正确;
D.甲醛与苯酚反应,苯酚提供羟基邻位上的两个氢原子,醛提供羰基的氧原子生成水脱去,从而缩聚生成酚醛树脂,反应为n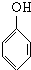 +nHCHO$→_{△}^{催化剂}$
+nHCHO$→_{△}^{催化剂}$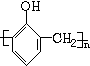 +nH2O,故D错误;
+nH2O,故D错误;
故选D.
点评 本题考查有机物的结构与性质及有机反应方程式书写,为高频考点,把握有机物官能团与性质的关系、反应类型与反应条件为解答的关键,题目难度不大.

练习册系列答案
相关题目
17.下列关于反应速率的说法错误的是( )
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 可逆反应达到化学平衡状态时,正、逆反应速率都为0 | |
| C. | 决定反应速率的主要因素是反应物的性质 | |
| D. | 增大反应物浓度,提高反应温度都能增大反应速率 |
14.化学与日常生活密切相关,下列说法正确的是( )
| A. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| B. | 从海水提取物质都必须通过化学反应才能实现 | |
| C. | 浓硫酸可刻蚀石英制艺术品 | |
| D. | 葡萄糖中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 |
11.葡萄糖酸钙是一种可促进骨骼生长的营养物质,葡萄糖酸钙可通过以下反应制得:
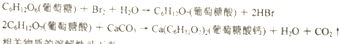
相关物质的溶解性见下表:
实验流程如下:

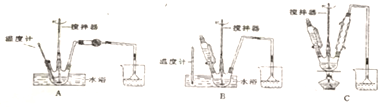
请回答下列问题:(1)第①步中溴水氧化葡萄糖时,下列装置最适合的是B.
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是C.
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是提高葡萄糖酸的转化率,便于后续分离;本实验中不宜用CaCl2替代CaCO3,理由是氯化钙难以与葡萄糖酸直接反应生成葡萄糖酸钙沉淀.
(3)第③步需趁热过滤,其原因是葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品.
(4)第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出.
(5)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液.
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

请回答下列问题:(1)第①步中溴水氧化葡萄糖时,下列装置最适合的是B.

制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是C.
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是提高葡萄糖酸的转化率,便于后续分离;本实验中不宜用CaCl2替代CaCO3,理由是氯化钙难以与葡萄糖酸直接反应生成葡萄糖酸钙沉淀.
(3)第③步需趁热过滤,其原因是葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品.
(4)第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出.
(5)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液.
18.在下列反应中,光照对反应几乎没有影响的是( )
| A. | 氯气与氢气的反应 | B. | 氯气与甲烷的反应 | ||
| C. | 氟气与氢气的反应 | D. | 次氯酸的分解 |
15.下列从混合物中分离出其中的一种成分,所采取分离方法正确的是( )
| A. | 由于碘在酒精中的溶解度大,所以,可用酒精把碘水中的碘萃取出来 | |
| B. | 水的沸点是100℃,酒精的沸点是78.5℃,所以,可用加热蒸馏方法使含水酒精变成无水酒精 | |
| C. | 氯化钠的溶解度随着温度下降而减少,所以,用冷却法从热的含有少量硝酸钾浓溶液中得到纯净的氯化钠晶体 | |
| D. | 在实验室中,通常采用加热氯酸钾和二氧化锰的混合物方法制取氧气.我们可以用溶解.过滤的方法从反应产物中得到二氧化锰 |
16.某原子的原子核外最外层电子排布为ns2np4,按照共用电子对理论,该原子一般可形成共用电子对的数目是( )
| A. | 1对 | B. | 2对 | C. | 3对 | D. | 4对 |

 某研究性学习小组为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列三种不同实验方案进行探究,请根据他们的设计回答有关问题.
某研究性学习小组为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列三种不同实验方案进行探究,请根据他们的设计回答有关问题.