题目内容
【题目】(题文)黑色固体A加热至红热投入无色溶液B中发生如下转化关系,已知X是两种气体组成的混合气体,其中一种为红棕色气体。

(1)由此可以推断:A为________,B为________,C为________,E为________。
(2)写出D与F反应的化学方程式____________________________________。
【答案】C浓硝酸NO和CO2NO3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
【解析】
X是两种气体组成的混合气体,其中一种为红棕色气体,则红棕色气体为NO2,一般为碳和浓硝酸的反应,A为C,B为浓硝酸,二者反应生成CO2、NO2、H2O,二氧化氮溶于水生成硝酸和NO,因此C为NO和CO2,E为NO,白色沉淀为碳酸钙,D为稀硝酸,蓝色溶液G为硝酸铜,则F为Cu,结合对应物质的性质以及题目要求解答该题。
根据以上分析可知A为C,B为浓硝酸,C为NO和CO2,D为稀硝酸,E为NO,F为Cu,G是硝酸铜,X是NO2和CO2,则
(1)由以上分析可知A为C,B为浓硝酸,C为NO和CO2,E为NO;
(2)D与F为铜和稀硝酸的反应,方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为______________。
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是______(填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
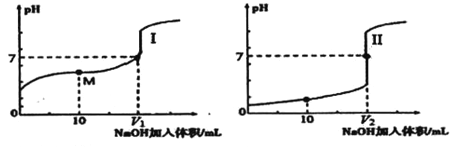
①滴定醋酸的曲线是_________(填“I”或“Ⅱ”)。
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是_______。
③V1和V2的关系:V1___V2(填“>”、“=”或“<”)。
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI。
操作步骤 | 现象 |
步骤1:向2mL0.005mol/LAgNO3溶液中加入2mL0.005mol/L KSCN溶液,静置。 | 出现白色沉淀 |
步骤2:取1mL上层清液于试管中,滴加1滴2mol/LFe(NO3)3溶液。 | 溶液变红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3mol/LAgNO3溶液。 | 现象a,溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3mol/LKI溶液。 | 出现黄色沉淀。 |
①写出步骤2中溶液变红色的离子方程式_____________。
②步骤3中现象a是_____________。
③用化学平衡原理解释步骤4的实验现象___________。