��Ŀ����
����Ŀ���Ե�ⷨ���������̲������������У����̺����ߴ�40%��50%����Ҫ�ɷ�ΪMnO2��ˮ����Һ�����������Pb2+��Sn2+���ؽ������ʡ������ղ��ø�����ά�ص�ľм�ڽ�Ũ����������£����͡�ˮ�⣬���������ǣ����������£����������������еĶ������̷�Ӧ���ɿ����Ե������̡�

�ش��������⣺
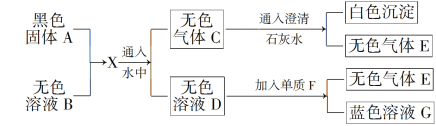
��1����ҵ�ϵ�������̵�ˮ��Һ���������̣������ĵ缫��ӦʽΪ__________��
��2����ƽ�������������з�����Ӧ�Ļ�ѧ����ʽ��C6 H12O6+_____MnO2+_____H2SO4=____MnSO4+____CO2��+____H2O��_____________________
��3����ȡ�����������������裬�������______���壨д��ѧʽ������Ⱦ������
��4�������յ�һ�ָ���Ʒ����Ҫ��ũҵ�������ϣ�д���仯ѧʽ��__________��
��5��ȡһ���������������ʵ��������õ�����ͼ����������������Ϊ_____mL������������������������ᵼ��________��(д��ѧʽ)������������

��6��ij��������MnO2����������Ϊ50.0%����174 g����������320 gŨ����(������������Ϊ36.5%)��ϼ��ȣ�������������ڱ�״����Ӧ����_____L����ȷ��0.1�������������е������ɷֲ����뷴Ӧ����
���𰸡� 4OH- -4e- =2H2O+O2�� 12��12��12��6��18 H2S��SO2 (NH4)2SO4 28 CaCO3 17. 9
����������1����ҵ�ϵ�������̵�ˮ��Һ���������̣������ĵ缫��ӦʽΪ4OH- -4e- =2H2O+O2����
��2�� �������������з�����Ӧ�Ļ�ѧ����ʽΪC6H12O6+12MnO2+12H2SO4=12MnSO4+6CO2��+18H2O��
��3����ȡ�����������������裬���������麟��ؽ���ʱ����Ũ�����������������ǿ�����ԣ�������立�Ӧ�������H2S��SO2�������Ⱦ������
��4�������յ�һ�ָ���Ʒ���������Ҫ��ũҵ�������ϣ��仯ѧʽΪ(NH4)2SO4��
��5����ͼ���֪�����������Ϊ28mLʱ���̵Ľ�������ߣ�������������������Ϊ28mL������������������������ᵼ�º��������CaCO3������������
��6��174 g�������ຬMnO2������Ϊ87g�������ʵ���Ϊ1mol��320 gŨ����(������������Ϊ36.5%)��HCl�����ʵ���Ϊ3.2mol���ɷ�Ӧ�Ļ�ѧ����ʽ��֪��Ũ����㣬����Ũ���ᷴӦһ��ʱ�����Ũ�ȼ�С��һ���̶ȺͲ��ٷ�Ӧ�ˣ�����������������ʵ���ҪС��![]() n(HCl)����С��0.8mol���ڱ�״�������������Ӧ����17. 9L��
n(HCl)����С��0.8mol���ڱ�״�������������Ӧ����17. 9L��

 ��ְٷְټ���ϵ�д�
��ְٷְټ���ϵ�д� �����ƻ���ĩ��̶�100��ϵ�д�
�����ƻ���ĩ��̶�100��ϵ�д� �ܿ���ȫ��100��ϵ�д�
�ܿ���ȫ��100��ϵ�д�����Ŀ���������滯ѧ���������ݣ��ж����з���������ʱ��ȶ�����(����)
��ѧ�� | H��H | H��F | H��Br | H��I |
����(kJ/mol) | 436 | 565 | 368 | 297 |
A.����B.������C.�廯��D.�⻯��
����Ŀ����һ���¶��£�������X������Y��0.32mol����10L�����ܱ������У�������Ӧx(g)+ Y(g) ![]() 2Z(g)AH<0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±���
2Z(g)AH<0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±���
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.24 | 0.22 | 0.20 | 0.20 |
����˵����ȷ������ ��
A. ��Ӧǰ2min ��ƽ������ v(Z)=4.0��10-3mol/(L��min)
B. �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰv������>v������
C. ���¶��´˷�Ӧ��ƽ�ⳣ��k=1.44
D. �����������䣬�ٳ���0.2molZ��ƽ��ʱX�����������С