题目内容
12.甲、乙、丙、丁4种溶液中各含一种Xn-离子(Xn-可以代表Cl-、Br-、I-、S2-中任意一种)先向甲中加人淀粉溶液和氯水,溶液变橙色.再加入丙溶液,颜色没有明显变化,最后向溶液中加入丁溶液,溶液褪色且浑浊.则甲、乙、丙、丁中依次含有的离子为( )| A. | Br-,I-,Cl-,S2- | B. | Br-,Cl-,I-,S2- | C. | Br-,Cl-,S2-,I- | D. | Cl-,I-,S2--,Br- |
分析 依据氯气的氧化性强于溴,溴的氧化性强于碘,碘的氧化性强于硫解答.
解答 解:氯气的氧化性强于溴,溴的氧化性强于碘,碘的氧化性强于硫,
向甲中加入淀粉溶液和新制氯水,溶液变为橙色而不是蓝色,说明甲中含Br-,发生的反应为:2Br-+Cl2═Br2+2Cl-;再加入丙溶液,颜色无明显变化,说明丙溶液中含有Cl-,最后向溶液中加入丁溶液,溶液褪色且浑浊,说明乙溶液含I-,丁中含有硫离子,发生反应:S2-+Br2=Br-+S↓,
所以甲、乙、丙、丁中依次含有的离子:Br-,I-,Cl-,S2-;
故选:A.
点评 本题考查了离子的判断,熟悉卤素单质氧化性强弱是解题关键,题目难度不大.

练习册系列答案
相关题目
2.下列叙述正确的是( )
| A. | 电解饱和食盐水制烧碱采用离子交换膜法,可以阻止阳离子通过 | |
| B. | 在铁上镀锌时,锌棒作阳极,且电解液硫酸锌的浓度是不变的 | |
| C. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| D. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH |
20.下列离子组一定能大量共存的是( )
| A. | 含大量OH-的溶液中:CO32-、Cl-、F-、K+ | |
| B. | 甲基橙呈黄色的溶液中;I-、Cl-、NO3-、Na+ | |
| C. | 石蕊呈蓝色的溶液中:Na+、AlO2-、NO3-、HCO3- | |
| D. | 含大量Al3+的溶液中:K+、Na+、NO3-、ClO- |
7.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol NaHSO4晶体中离子总数为3NA | |
| B. | 2.24L14CH4分子中所含中子数为0.8NA | |
| C. | 0.1L 3 mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3 NA | |
| D. | 标况下,将FeSO4溶液置于空气中,被氧化的Fe2+为0.2 NA,吸收O2为1.12 L |
17.将SO2气体通入下列物质中,不可能发生氧化还原反应的是( )
| A. | FeCl3 | B. | H2O2溶液 | C. | 浓H2SO4 | D. | Na2S溶液 |
4.有8gNa2O2、Na2O、Na2CO3、NaOH的混合物与200g质量分数为3.65%的盐酸恰好完全反应,蒸干溶液,最终得到的固体质量为( )
| A. | 8g | B. | 15.5g | C. | 11.7g | D. | 无法确定 |
 茶叶中含咖啡碱,能溶于水、乙醇,更易溶于氯仿(CHCl3),178℃时快速升华.另外茶叶中还含有11%~12%的丹宁酸,也易升华,易溶于水及乙醇,但不溶于氯仿.现从茶叶中提取咖啡碱流程如下:
茶叶中含咖啡碱,能溶于水、乙醇,更易溶于氯仿(CHCl3),178℃时快速升华.另外茶叶中还含有11%~12%的丹宁酸,也易升华,易溶于水及乙醇,但不溶于氯仿.现从茶叶中提取咖啡碱流程如下: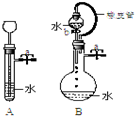 根据如图描述回答下列问题:
根据如图描述回答下列问题: