题目内容
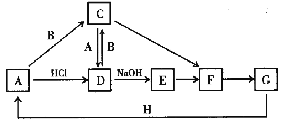
【题目】A~H 是中学化学中常见的物质,转化关系如下图所示(部分反应物、反应条件和产物已略去)。A、H 是常见的金属单质,工业上常用电解法冶炼H;通常状况下B 为黄绿色气体;G 为红棕色固体;C、D、E、F、G 物种化合物含有同一种元素。
(1) B 的电子式为____________。
(2) 检验D中金属阳离子的实验方案是____________。
(3) 金属H 既能与强酸反应又能与强碱反应,其与NaOH 溶液反应的离子方程式为____________。
(4) E 在空气中转化成F 的化学方程式为____________。
(5) 理论上G 与H 反应生成1mol 固体A 放出428kJ 热量,G 与H 反应的热化学方程式为____________。
(6) 单质A 在氧气中的燃烧产物X 可用于去除地下水中的![]() 具有放射性)。在酸性条件下,X 将TcO4-转化为难溶于水的TcO2,同时得到F,该反应的离子方程式为____________。
具有放射性)。在酸性条件下,X 将TcO4-转化为难溶于水的TcO2,同时得到F,该反应的离子方程式为____________。
【答案】![]() 取少量D溶液于试管中,先滴加KSCN溶液再滴加氯水,若滴加KSCN溶液时未出现明显现象,滴加氯水后出现血红色,则D溶液中含Fe2+(或取少量D溶液于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀,则D溶液中含Fe2+) 2Al + 2OH-+ 2H2O = 2AlO2-+ 3H2↑ 4Fe(OH)2+ O2+ 2H2O = 4Fe(OH)3 2Al(s) + Fe2O3(s) = 2Fe(s) + Al2O3(s) ΔH = -856 kJ·mol-1 3Fe3O4+ TcO4-+ H++13H2O = 9Fe(OH)3+ TcO2
取少量D溶液于试管中,先滴加KSCN溶液再滴加氯水,若滴加KSCN溶液时未出现明显现象,滴加氯水后出现血红色,则D溶液中含Fe2+(或取少量D溶液于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀,则D溶液中含Fe2+) 2Al + 2OH-+ 2H2O = 2AlO2-+ 3H2↑ 4Fe(OH)2+ O2+ 2H2O = 4Fe(OH)3 2Al(s) + Fe2O3(s) = 2Fe(s) + Al2O3(s) ΔH = -856 kJ·mol-1 3Fe3O4+ TcO4-+ H++13H2O = 9Fe(OH)3+ TcO2
【解析】
通常状况下B为黄绿色气体,则B为Cl2,A是常见的金属单质,且A与盐酸反应生成D,D又与氯气反应生成C,A也能与氯气反应生成C,且A与C反应生成D,则A应为Fe,D为FeCl2,C为FeCl3,C、D、E、F、G物种化合物含有同一种元素,且G为红棕色固体,D与氢氧化钠反应生成E为Fe(OH)2,E氧化得F为Fe(OH)3,F受执分解得G为Fe2O3,H是常见的金属单质,工业上常用电解法冶炼H,金属H既能与强酸反应又能与强碱反应,则H应为Al,氧化铁与铝发生铝热反应得铁,符合各物质的转化关系,据此答题。
(1)根据上面的分析可知,B为Cl2,B的电子式为![]() ,
,
故答案为:![]() ;
;
(2)D为FeCl2,检验D中金属阳离子的实验方案是先滴加KSCN溶液再滴加氯水,若滴加KSCN溶液时未出现明显现象,滴加氯水后出现血红色,则D溶液中含Fe2+(或取少量D溶液于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀,则D溶液中含Fe2+),
故答案为:先滴加KSCN溶液再滴加氯水,若滴加KSCN溶液时未出现明显现象,滴加氯水后出现血红色,则D溶液中含Fe2+(或取少量D溶液于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀,则D溶液中含Fe2+);
(3)金属H既能与强酸反应又能与强碱反应,其与NaOH溶液反应的离子方程式为 2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(4)E为Fe(OH)2,E在空气中转化成F的化学方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(5)G为Fe2O3,理论上G与H反应生成1mol固体Fe放出428kJ热量,则生成2mol铁应放出856kJ热量,G与H反应的热化学方程式为2Al(s)+Fe2O3(s)═2Fe(s)+Al2O3(s)△H=-856kJmol-1,
故答案为:2Al(s)+Fe2O3(s)═2Fe(s)+Al2O3(s)△H=-856kJmol-1;
(6)单质铁在氧气中的燃烧产物X应为Fe3O4,在酸性条件下,Fe3O4将TcO4--转化为难溶于水的TcO2,同时得到Fe(OH)3,该反应的离子方程式为3Fe3O4+TcO4-+H++13H2O═9Fe(OH)3+TcO2,
故答案为:3Fe3O4+TcO4-+H++13H2O═9Fe(OH)3+TcO2。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案