题目内容
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓)![]() CuSO4+A↑+2H2O,试完成下面的问题:
CuSO4+A↑+2H2O,试完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于______(用字母代号填写)
a.酸 b. 碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)该反应中被氧化的元素是_________________,参加反应的氧化剂与还原剂的物质的量之比为______。
(3)写出该反应的化学方程式并用双线桥标出电子转移的方向和数目:____________。
【答案】d Cu 1︰1 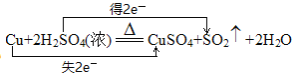
【解析】
(1)由质量守恒定律分析A为SO2,据此判断;
(2)反应中Cu元素的化合价升高,S元素的化合价降低;
(3)根据电子得失守恒解答。
(1)A物质可以导致酸雨的形成,根据原子守恒可知A是二氧化硫,应该属于酸性氧化物;故答案为d;
(2)反应中Cu元素的化合价升高,Cu元素被氧化,S元素的化合价降低,硫酸被还原,2mol硫酸参加反应,有1mol作氧化剂,则参加反应的氧化剂与还原剂的物质的量之比为1:1;
(3)反应中Cu元素的化合价升高2价,S元素的化合价降低2价,转移2个电子,则用双线桥标出电子转移的方向和数目为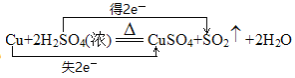 。
。

练习册系列答案
相关题目