题目内容
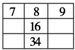
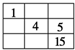
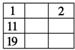
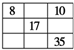
8. 短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为20.则下列说法不正确的是( )
短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为20.则下列说法不正确的是( )| A. | 最高价氧化物的水化物的酸性:X<Z | |
| B. | 原子半径大小:Y<X<W | |
| C. | 氢化物的稳定性X<Y | |
| D. | X和Y形成的化合物升华破坏的是共价键 |
分析 W、X、Y、Z均为短周期主族元素,由位置关系可知,X、Y处于第二周期,W、Z处于第三周期,设W原子最外层电子数为a,则X、Y、Z最外层电子数依次为a+1、a+3、a+4,四种元素的原子最外层电子数之和为20,则:a+a+1+a+3+a+4=20,解得a=3,则W为Al元素,故X为C元素、Y为O元素、W为Cl元素,据此解答.
解答 解:W、X、Y、Z均为短周期主族元素,由位置关系可知,X、Y处于第二周期,W、Z处于第三周期,设W原子最外层电子数为a,则X、Y、Z最外层电子数依次为a+1、a+3、a+4,四种元素的原子最外层电子数之和为20,则:a+a+1+a+3+a+4=20,解得a=3,则W为Al元素,故X为C元素、Y为O元素、W为Cl元素.
A.X、T最高价氧化物的水化物分别为碳酸、高氯酸,碳酸酸性比高氯酸弱,故A正确;
B.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Y<X<W,故B正确;
C.非金属性C<O,故氢化物稳定性CH4<H2O,故C正确;
D.X和Y形成的化合物为CO2,属于分子晶体,升华破坏的是分子间注意力,故D错误,
故选D.
点评 本题考查结构性质位置关系应用,难度不大,根据位置判断元素所处的周期是推断关键,注意掌握元素周期表的结构与元素周期律.

练习册系列答案
相关题目
18.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1Ca(NO3)2溶液中:Na+、N${{H}_{4}}^{+}$、C${{O}_{3}}^{2-}$、CH3COO- | |
| B. | 能使甲基橙变红的溶液中:K+、Na+、N${{O}_{3}}^{-}$、Cl- | |
| C. | 3%H2O2溶液中:Fe2+、H+、S${{O}_{4}}^{2-}$、Cl- | |
| D. | 0.1 mol•L-1KSCN溶液中:Fe3+、N${{H}_{4}}^{+}$、Br-、S${{O}_{4}}^{2-}$ |
16.下列有机物属于烃的是( )
| A. | CH3Cl | B. | C6H6 | C. | C6H12O6 | D. | CH3CHO |
3.能通过化学反应使溴水褪色,能使高锰酸钾溶液褪色的是( )
| A. | 甲烷 | B. | 乙烯 | C. | 乙烷 | D. | 苯 |
17.下列元素中,金属性最强的是( )
| A. | 钾 | B. | 钠 | C. | 镁 | D. | 铝 |
 铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:
铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题: ;
;