题目内容
在容积可变的密闭容器中,1molN2和4molH2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时的氮气的体积分数接近于
| A.5% | B.10% | C.15% | D.20% |
C
解析试题分析:根据三行式计算。
N2+3H2 2NH3,
2NH3,
起始量(mol) 1 4 0
变化量(mol) 1/3 1 2/3
平衡量(mol) 2/3 3 2/3
根据阿伏加德罗定律:同温同压下,气体的物质的量之比等于体积之比知,平衡时的氮气的体积分数接近15%,选C。
考点:考查化学平衡计算。

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
下列条件的改变,一定能加快化学反应速率的是
| A.增大压强 | B.升高温度 |
| C.增大反应物的量 | D.减小生成物的浓度 |
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是 ( )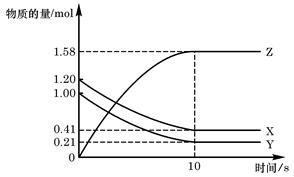
| A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s) |
| B.反应开始到10s, X的物质的量浓度减少了0.79mol/L |
| C.反应开始时10s, Y的转化率为79.0% |
D.反应的化学方程式为:X(g)+ Y(g) Z(g) Z(g) |
下列措施一定能使化学反应速率加快的是( )
| A.增大反应物的量 | B.增大压强 | C.升高温度 | D.使用催化剂 |
下列事实不能用勒沙特列原理解释的是( )
| A.氨水应密闭保存,放置低温处 |
| B.在FeC12溶液中加入铁粉防止氧化变质 |
| C.常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5 |
| D.实验室可用排饱和食盐水的方法收集氯气 |
常温下,0.2 mol·L-1的盐酸30mL分别与下列Na2CO3溶液混合,再加水稀释到100mL,其中最初产生CO2的速率最快的是
| A.20mL0.3 mol·L-1Na2CO3 | B.10mL0.4 mol·L-1Na2CO3 |
| C.25mL0.4 mol·L-1Na2CO3 | D.15mL0.5 mol·L-1Na2CO3 |
下列叙述中一定能判断某化学平衡发生移动的是( )
| A.混合物中各组分的浓度改变 | B.正、逆反应速率改变 |
| C.混合物中各组分的含量改变 | D.混合体系的压强发生改变 |
 B+C(g) ΔH=" +Q" kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g) ΔH=" +Q" kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是