题目内容
常温下,0.2 mol·L-1的盐酸30mL分别与下列Na2CO3溶液混合,再加水稀释到100mL,其中最初产生CO2的速率最快的是
| A.20mL0.3 mol·L-1Na2CO3 | B.10mL0.4 mol·L-1Na2CO3 |
| C.25mL0.4 mol·L-1Na2CO3 | D.15mL0.5 mol·L-1Na2CO3 |
C
解析试题分析:0.2 mol·L-1的盐酸30mL分别与Na2CO3溶液混合,再加水稀释到100mL时,就只考虑每一种Na2CO3溶液所含有的Na2CO3的物质的量的多少,含有的Na2CO3的物质的量的越多,溶液的浓度越大,最初产生CO2的速率最快:A、20mL*0.3 mol·L-1="0.006" mol Na2CO3 B、10mL*0.4 mol·L-1="0.004" mol Na2CO3,C、25mL*0.4 mol·L-1="0.01" mol Na2CO3 D、15mL*0.5 mol·L-1="0.0075" mol Na2CO3,所以C项溶液中含有的Na2CO3的物质的量最多,最初产生CO2的速率最快,正确。
考点:考查浓度对化学反应速率的影响。

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
在容积可变的密闭容器中,1molN2和4molH2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时的氮气的体积分数接近于
| A.5% | B.10% | C.15% | D.20% |
一定条件下存在反应:C(s)+H2O(g) CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。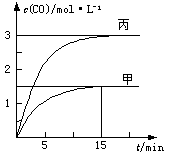
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | V |
| 温度 | T1 ℃ | T2 ℃ | T1 ℃ |
| 起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |
A.甲容器中,反应在前15 min的平均速率v(H2)="0.1" mol·L-1·min-1
B.丙容器的体积V<0.5 L
C.当温度为T1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)="0.4" mol,则T1< T2
己知: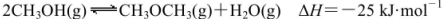 。某温度下的平衡常数为400。此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如表,下列说法中不正确的是
。某温度下的平衡常数为400。此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如表,下列说法中不正确的是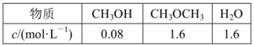
| A.此时刻反应达到平衡状态 |
| B.容器内压强不变时,说明反应达平衡状态 |
| C.平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变 |
| D.平衡时,反应混合物的总能量降低40 kJ |
某温度下,对可逆反应2X(g) + Y(g)  3Z(g) + W(s) ΔH>0 的叙述正确的是
3Z(g) + W(s) ΔH>0 的叙述正确的是
| A.加入少量W,逆反应速率增大,平衡向左移动 |
| B.增大压强,正反应速率增大,逆反应速率减小 |
| C.温度、体积不变,充入He气增大压强,反应速率会加快 |
| D.升高温度,混合气体的平均相对分子质量减小 |
下列关于化学反应速率的说法正确的是 ( )
| A.化学反应速率是指单位时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加 |
| B.化学反应速率为0.8 mol /(L·s)是指1s 时某物质的浓度为0.8mol/L |
| C.根据化学反应速率的大小可以知道化学反应进行的快慢 |
| D.决定反应速率的主要因素是反应物的浓度 |

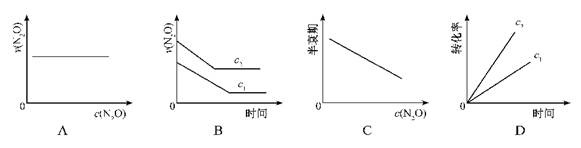 、
、 N2O4△H<0)下列叙述正确的是
N2O4△H<0)下列叙述正确的是