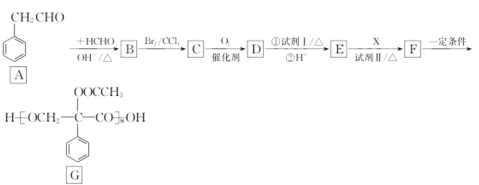
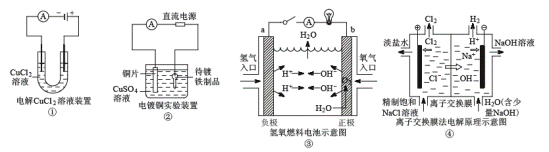
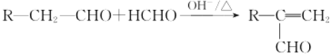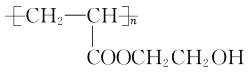题目内容
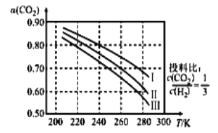
【题目】在催化剂作用下,可逆反应2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)在温度为323K和343K时SiHCl2的转化率随时间变化的结果如图所示(已知:反应速率v=v正-v逆=k正![]() -k逆
-k逆![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数)。下列说法错误的是
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数)。下列说法错误的是

A.343K时,反应的平衡转化率为22%
B.343K时,反应的平衡常数约为0.02
C.323K时,提高反应物压强或浓度可缩短反应达到平衡的时间
D.a处的![]() 1.1,且a处的反应速率大于b处的反应速率
1.1,且a处的反应速率大于b处的反应速率
【答案】D
【解析】
对于一个平衡体系,升高温度,反应速率加快,达平衡的时间缩短,则a点所在的曲线为343K时的曲线。
A.从图中可以看出,343K时,反应的平衡转化率为22%,A正确;
B.343K时,反应物的转化率为22%,假设其物质的量浓度为1mol/L,则平衡时反应物浓度为0.78mol/L,生成物浓度各为0.11mol/L,平衡常数K=![]() ≈0.02,B正确;
≈0.02,B正确;
C.323K时,提高反应物压强或浓度,都可加快反应速率,从而缩短反应到达平衡的时间,C正确;
D.平衡时,v正=v逆,![]() K=0.02,a处的
K=0.02,a处的![]()
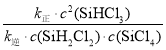 =
=![]() =1.3;因为v正>v逆,所以a处的反应速率大于b处的反应速率,D错误;
=1.3;因为v正>v逆,所以a处的反应速率大于b处的反应速率,D错误;
故选D。

练习册系列答案
相关题目