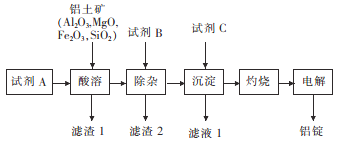
题目内容
【题目】常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如下图所示: 下列有关说法正确的是
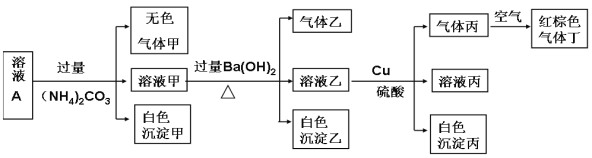
A.该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子
B.实验消耗Cu 14.4g,则生成气体丁的体积为3.36L
C.沉淀乙一定有BaCO3,可能有BaSO4
D.一定没有Fe3+,但是无法确定是否含有I-
【答案】A
【解析】
试题分析:pH=1,说明溶液显强酸性,说明有H+,CO32-一定不存在,A、溶液A中加入过量的(NH4)2CO3溶液,Fe3+和CO32-发生双水解,生成氢氧化铁沉淀(红褐色),说明原溶液中不含Fe3+,但溶液乙中加入Cu和硫酸,产生气体丙,气体丙遇空气变成红棕色气体丁因此,丁为NO2,丙为:NO,说明原溶液中有NO3-,但是NO3-在酸性条件下具有氧化性,因为Fe2+、I-具有还原性,因此不能大量存在,因此白色沉淀甲为Al(OH)3,原溶液中含有Al3+,根据溶液显电中性,阳离子所带的电荷数总物质的量浓度为3n(Al3+)+n(H+)=3×0.1+0.1=0.4mol·L-1,而NO3-所带电荷数为0.1mol·L-1,又因为各离子浓度为0.1mol·L-1,因此原溶液中含有SO42-、Cl-,故正确;B、题目中没有说标准状况,因此无法计算气体体积,故错误;C、因为加的是过量的(NH4)2CO3,所以有Ba2++CO32-=BaCO3↓,根据A选项的分析,原溶液中有SO42-,因此也就有Ba2++SO42-=BaSO4↓,因此沉淀乙一定是BaCO3、BaSO4,故错误;D、根据A选项的分析,原溶液中一定没有I-,故错误。