题目内容
【题目】下列关于有机化合物的说法正确的是( )
A. 2-甲基丁烷也称异丁烷(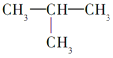 )
)
B. 由乙烯生成乙醇属于加成反应
C. C4H9Cl有3种同分异构体,C3H6Cl2也有3种同分异构体
D. 苯分子中不存在双键,苯使溴水褪色是因为发生了取代反应
【答案】B
【解析】
A.异丁烷含有4个C原子,2-甲基丁烷含有5个C原子,故A项错误;
B.乙烯与水在催化剂加热的条件下发生加成反应生成乙醇,故B项正确;
C. C4H10的同分异构体有:CH3CH2CH2CH3、CH3CH(CH3)CH3这两种,CH3CH2CH2CH3分子中有2种H原子,其一氯代物有2种;CH3CH(CH3)CH3分子中有2种H原子,其一氯代物有2种;故C4H9Cl的同分异构体共有4种;C3H8只有1种结构简式:CH3CH2CH3,2个Cl原子取代同一个C原子上的H原子时其二氯代物有2种,取代不同C原子上的H原子时的二氯代物有2种,共4种,故C项错误;
D. 苯中不含碳碳双键,不能和溴水发生加成反应而使溴水褪色,苯使溴水褪色是因为溴在苯中的溶解度大于在水中的溶解度,发生萃取褪色,不发生化学反应,是物理变化,故D项错误;
故答案选B。

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目