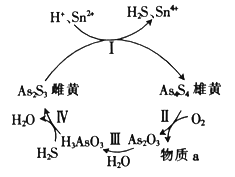
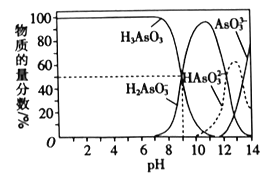
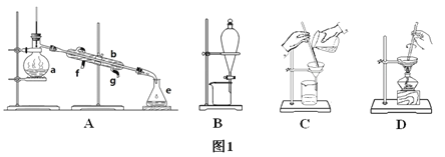
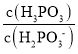题目内容
【题目】对于反应MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑,下列说法正确的是( )
MnCl2+2H2O+Cl2↑,下列说法正确的是( )
A.MnO2是还原剂
B.HCl 是氧化剂
C.若生成7.1gCl2,则转移0.1 mol电子
D.若生成7.1gCl2,被氧化的盐酸的物质的量是0.2mol
【答案】D
【解析】
反应MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑,二氧化锰中锰化合价降低,得到电子,盐酸中氯化合价升高,失去电子,电子转移为
MnCl2+2H2O+Cl2↑,二氧化锰中锰化合价降低,得到电子,盐酸中氯化合价升高,失去电子,电子转移为
 。
。
A选项,MnO2中锰化合价降低,因此二氧化锰作氧化剂,故A错误;
B选项,HCl中氯化合价升高,失去电子,作还原剂,故B错误;
C选项,根据上面分析得到1 mol氯气转移2 mol电子,因此若生成7.1g Cl2物质的量0.1mol,则转移0.2 mol电子,故C错误;
D选项,根据方程式中生成1 mol氯气,有4 mol盐酸参与反应,但有2mol盐酸被氧化,有2 mol盐酸作酸性,因此若生成7.1gCl2即物质的量为0.1 mol,被氧化的盐酸的物质的量是0.2mol,故D正确;
综上所述,答案为D。

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
【题目】下列根据实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向NaHS溶液中滴入酚酞 | 溶液变红色 | HS-水解程度大于电离程度 |
B | 向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
C | 向Na2CO3溶液中加入浓盐酸,将产生的气体通入硅酸钠溶液中 | 产生白色浑浊 | 酸性:盐酸>碳酸>硅酸 |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在I |
A. AB. BC. CD. D