题目内容
【题目】实验室制备1,2—二溴乙烷的反应原理如下:CH3CH2OH ![]() CH2=CH2+H2O,CH2=CH2+Br2
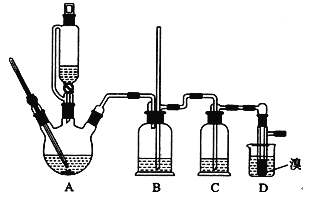
CH2=CH2+H2O,CH2=CH2+Br2![]() BrCH2CH2Br。用少量的溴和足量的乙醇制备l,2—二溴乙烷的装置如图所示,有关数据如下表:
BrCH2CH2Br。用少量的溴和足量的乙醇制备l,2—二溴乙烷的装置如图所示,有关数据如下表:
乙醇 | 1,2—二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
⑴在装置c中应加入______(选填序号),其目的是吸收反应中可能生成的酸性气体。
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
⑵将二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的________层。(填“上”或“下”)
⑶判断d管中制备二溴乙烷反应已结束的最简单方法是_________________________。
⑷若产物中有少量未反应的Br2,最好用________(填正确选项前的序号)洗涤除去。
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
⑸以1,2—二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2—二溴乙烷通过(①)反应制得(②),②通过(③)反应制得氯乙烯,由氯乙烯制得聚氯乙烯。
①______________(填反应类型),其化学方程式__________________。
②______________(填反应类型)。
【答案】 ③ 下 溴的颜色完全褪去 ② 消去反应 ![]() 加成反应
加成反应
【解析】(1)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应而被吸收,答案选③;(2)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,有机层在下层;(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,D中溴颜色完全褪去说明反应已经结束;(4)①.溴更易溶于1,2-二溴乙烷,用水无法除去溴,错误;②.常温下Br2和氢氧化钠发生反应:2NaOH+Br2=NaBr+NaBrO+H2O,再分液除去,正确;③.NaI与溴反应生成碘,碘与1,2-二溴乙烷互溶,不能分离,错误;④.酒精与1,2-二溴乙烷互溶,不能除去混有的溴,错误,答案选②;(5)1,2—二溴乙烷通过消去反应反应制得乙炔,方程式为![]() ;乙炔和氯化氢发生加成反应制得氯乙烯,最后由氯乙烯通过加聚反应制得聚氯乙烯。
;乙炔和氯化氢发生加成反应制得氯乙烯,最后由氯乙烯通过加聚反应制得聚氯乙烯。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】过氧化尿素是一种新型漂泊、消毒剂,广泛应用与农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:
CO(NH2)2+H2O2![]() CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
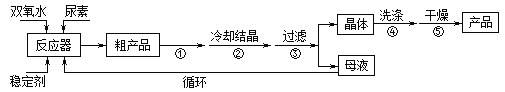
合成过氧化尿素的流程及反应装置图如图:

请回答下列问题:
(1)仪器X的名称是__________;冷凝管中冷却水从____(填“a”或“b”)口出来;
(2)该反应的温度控制30℃而不能过高的原因是_______________________。
(3)步骤①宜采用的操作是_____________。
A.加热蒸发 B.常压蒸发 C.减压蒸发
(4)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是_________________。
(5)准确称取1.000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加2mL6mol·L﹣1H2SO4,用0.2000mol·L﹣1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2·H2O2的质量分数为_____________;若滴定后俯视读数,则测得的过氧化尿素含量________(填“偏高”、“偏低”或“不变”)。