题目内容
【题目】下列说法正确的是( )
A.AlCl3溶液和NaAlO2溶液分别加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同
B.配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
C.用加热的方法可除去KNO3溶液中混有的Fe3+
D.泡沫灭火器中常使用的原料是碳酸钠和硫酸铝
【答案】C
【解析】AlCl3溶液和NaAlO2溶液的水解方程式分别为AlCl3+3H2O![]() Al(OH)3+3HCl,NaAlO2+2H2O
Al(OH)3+3HCl,NaAlO2+2H2O![]() Al(OH)3+NaOH,加热促进水解,由于盐酸是挥发性酸,因此前者最终产物为Al2O3,后者仍为NaAlO2,A项错误;选项B中很显然所配得的FeCl3溶液中混有杂质S
Al(OH)3+NaOH,加热促进水解,由于盐酸是挥发性酸,因此前者最终产物为Al2O3,后者仍为NaAlO2,A项错误;选项B中很显然所配得的FeCl3溶液中混有杂质S![]() ,B项错误;由于Fe3++3H2O
,B项错误;由于Fe3++3H2O![]() Fe(OH)3+3H+,升高温度可促进水解而产生沉淀,从而除去Fe3+杂质,C项正确;选项D中,为了加快产生CO2气体的速率,泡沫灭火器中常使用的原料是碳酸氢钠和硫酸铝,D项错误。
Fe(OH)3+3H+,升高温度可促进水解而产生沉淀,从而除去Fe3+杂质,C项正确;选项D中,为了加快产生CO2气体的速率,泡沫灭火器中常使用的原料是碳酸氢钠和硫酸铝,D项错误。

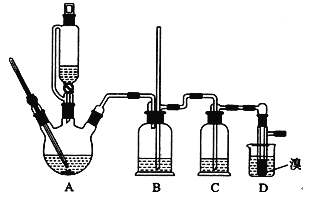
【题目】实验室制备1,2—二溴乙烷的反应原理如下:CH3CH2OH ![]() CH2=CH2+H2O,CH2=CH2+Br2
CH2=CH2+H2O,CH2=CH2+Br2![]() BrCH2CH2Br。用少量的溴和足量的乙醇制备l,2—二溴乙烷的装置如图所示,有关数据如下表:
BrCH2CH2Br。用少量的溴和足量的乙醇制备l,2—二溴乙烷的装置如图所示,有关数据如下表:
乙醇 | 1,2—二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
⑴在装置c中应加入______(选填序号),其目的是吸收反应中可能生成的酸性气体。
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
⑵将二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的________层。(填“上”或“下”)
⑶判断d管中制备二溴乙烷反应已结束的最简单方法是_________________________。
⑷若产物中有少量未反应的Br2,最好用________(填正确选项前的序号)洗涤除去。
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
⑸以1,2—二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2—二溴乙烷通过(①)反应制得(②),②通过(③)反应制得氯乙烯,由氯乙烯制得聚氯乙烯。
①______________(填反应类型),其化学方程式__________________。
②______________(填反应类型)。