题目内容
6.已知水在25℃和95℃时,其电离平衡曲线如图所示,下列说法错误的是( )
| A. | 95℃时,pH=4的H2SO4溶液中,由水电离出的c(OH-)=1×10-10mol/L | |
| B. | 15℃时,pH=7的溶液呈酸性 | |
| C. | AB连线上的点均表示中性溶液 | |
| D. | B点对应的温度高于A点对应的温度 |
分析 纵轴是氢离子浓度,横轴是氢氧根离子浓度,水的离子积常数Kw=c(H+)×c(OH-)计算出A曲线的Kw,然后结合水的电离过程吸热判断25℃时、95℃时水的电离平衡曲线,纯水在任何温度下,都是中性的,据此回答判断.
解答 解:纵轴是氢离子浓度,横轴是氢氧根离子浓度,水的离子积常数Kw=c(H+)×c(OH-)计算出A曲线的Kw=10-14,B曲线的Kw=10-12,水的电离是吸热的,所以A是25℃时水的电离平衡曲线,B是95℃时水的电离平衡曲线.
A、95℃时,pH=4的H2SO4溶液中,由水电离出的c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-4}}$mol/L=1×10-8mol/L,故A错误;
B、温度升高,水的电离受到促进,降低温度,抑制水的电离,所以降低温度,水的pH越大,15℃时,pH=7的溶液呈酸性,故B正确;
C、纯水在任何温度下,都是中性的,故C正确;
D、A是25℃时水的电离平衡曲线,B是95℃时水的电离平衡曲线,B点对应的温度高于A点,故D正确.
故选A.
点评 本题考了水的离子积常数计算、溶液的酸碱性的判断等,题目难度不大,注意温度对水的电离的影响.

练习册系列答案
相关题目
17.下列有关实验的叙述正确的是( )
| A. | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝,则原溶液中无NH4+ | |
| B. | 向Ca(ClO)2溶液通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | |
| C. | 光照氯水有气泡冒出,该气体为Cl2 | |
| D. | 用四氯化碳萃取溴水中的溴后,分液时,有机层应从分液漏斗的上口倒出 |
14.为了除去下列说法正确的是( )
| A. | 水导电性很差,所以水不是电解质 | |
| B. | 判断某化合物是否为电解质,应看其在一定条件下能否电离 | |
| C. | 酸、碱和盐类都属于电解质,其他化合物都不是电解质 | |
| D. | NaCl和HCl都是电解质,所以它们熔融状态下都能导电 |
1.下列实验中,所采取的分离方法与对应原理都正确的是( )
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离氢氧化铁胶体和氯离子 | 过滤 | 胶体不能透过半透膜,离子能 |
| B | 除去乙醇中的乙酸 | 蒸馏 | 先加生石灰,利用乙醇与乙酸盐沸点相差较大 |
| C | 除去苏打中少量小苏打 | 加热 | 二者的溶解度不同 |
| D | 分离植物油和水的混合物 | 分液 | 二者互不相溶且沸点不同 |
| A. | A | B. | B | C. | C | D. | D |
11.下列反应的离子方程式书写正确的是( )
| A. | 小块金属钠投入水中:Na+2H2O=Na++2OH-+H2↑ | |
| B. | Fe和盐酸溶液的反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 石灰石溶于盐酸:CaCO3+2H+══Ca2++H2O+CO2↑ | |
| D. | 锌片插入硝酸银溶液中:Zn+Ag+═Zn2++Ag |
14.下列叙述不正确的是( )
| A. | 常温常压下,3.2gO2所含的原子数为0.2NA | |
| B. | 标准状况下,18gH2O所含的氧原子数目为NA | |
| C. | 常温常压下,92gNO2和N2O4的混合气体中含有的原子总数为6NA | |
| D. | 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA |

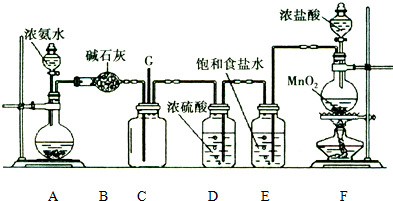


 .
. .
. (或
(或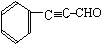 ).
). 、
、 、
、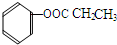 、
、 、
、 、
、 (写结构简式).
(写结构简式).