题目内容
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法:2Cu+H2O |
方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法II和方法III制取Cu2O而很少用方法I,其原因是 .
(2)己知:2Cu(s)+ ![]() O2(g)=Cu2O(s)△H=﹣akJmol﹣1C(s)+
O2(g)=Cu2O(s)△H=﹣akJmol﹣1C(s)+ ![]() O2(g)=CO(s)△H=﹣bkJmol﹣1
O2(g)=CO(s)△H=﹣bkJmol﹣1
Cu(s)+ ![]() O2(g)=CuO(s)△H=﹣ckJmol﹣1
O2(g)=CuO(s)△H=﹣ckJmol﹣1
则方法I发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=kJmol﹣1 .
(3)方法II采用离子交换膜控制电解液中OH﹣的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为 .
(4)方法III为加热条件下用液态拼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2 . 该制法的化学方程式为 .
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: 2H2O(g) ![]() 2H2(g)+O2(g)△H>0
2H2(g)+O2(g)△H>0
水蒸气的浓度随时间t变化如表所示.
序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是(填字母代号).
A.实验温度:T1<T2
B.实验①前20min的平均反应速率v(O2)=7×10﹣5mol/(Lmin)
C.实验②比实验①所用的催化剂效率高
(6)25℃时,向50mL0.018mol/L的AgNO3溶液中加入50mL0.02mol/L盐酸,生成沉淀.若已知Ksp(AgCl)=1.8×10﹣10 , 则此时溶液中的c(Ag+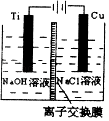
【答案】
(1)反应不易控制,易还原产生Cu
(2)2c﹣a﹣b
(3)2Cu﹣2e﹣+2OH﹣=Cu2O+H2O
(4)4Cu(OH)2+N2H4 ![]() 2Cu2O+N2↑+6H2O
2Cu2O+N2↑+6H2O
(5)AC
(6)1.8×10﹣7mol/L;否
【解析】解:(1)用炭粉在高温条件下还原CuO容易生成Cu,反应不易控制生成Cu2O; 所以答案是:反应不易控制,易还原产生Cu;(2)①2Cu(s)+ ![]() O2(g)=Cu2O(s)△H=﹣akJmol﹣1 , ②C(s)+
O2(g)=Cu2O(s)△H=﹣akJmol﹣1 , ②C(s)+ ![]() O2(g)=CO(g)△H=﹣bkJmol﹣1 , ③Cu(s)+
O2(g)=CO(g)△H=﹣bkJmol﹣1 , ③Cu(s)+ ![]() O2(g)=CuO(s)△H=﹣ckJmol﹣1
O2(g)=CuO(s)△H=﹣ckJmol﹣1
由盖斯定律可知,①﹣③×2+②得2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=2c﹣a﹣bkJmol﹣1;
所以答案是:2c﹣a﹣b;(3)阳极发生氧化反应,碱性条件下Cu在阳极失去电子得到Cu2O与H2O,阳极电极反应式为:2Cu﹣2e﹣+2OH﹣=Cu2O+H2O,
所以答案是:2Cu﹣2e﹣+2OH﹣=Cu2O+H2O;(4)液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2 , 其反应的方程式为:4Cu(OH)2+N2H4 ![]() 2Cu2O+N2↑+6H2O;
2Cu2O+N2↑+6H2O;
所以答案是:4Cu(OH)2+N2H4 ![]() 2Cu2O+N2↑+6H2O; (5)A、实验温度越高,达到化学平衡时水蒸气转化率越大,②和③相比,③转化率高,所以T2>T1 , 故A正确;
2Cu2O+N2↑+6H2O; (5)A、实验温度越高,达到化学平衡时水蒸气转化率越大,②和③相比,③转化率高,所以T2>T1 , 故A正确;
B、实验①前20min的平均反应速率 v(O2)= ![]() =
= ![]() =3.5×10﹣5 molL﹣1 min﹣1 , 故B错误;
=3.5×10﹣5 molL﹣1 min﹣1 , 故B错误;
C、①②化学平衡状态未改变,②反应速率加快,先到达平衡,则实验②比实验①所用的催化剂效率高,故C正确.
故选AC;(6)溶液混合后,不发生反应时c(Ag+)= ![]() ×0.018molL﹣1=0.009molL﹣1、c(Cl﹣)=
×0.018molL﹣1=0.009molL﹣1、c(Cl﹣)= ![]() ×0.02molL﹣1=0.01molL﹣1 , 令平衡时溶液中Ag+的浓度为xmol/L,
×0.02molL﹣1=0.01molL﹣1 , 令平衡时溶液中Ag+的浓度为xmol/L,
Ag+(aq)+Cl﹣(aq)AgCl(s)
(0.009﹣x)mol/L (0.009﹣x)mol/L
反应后溶液中c(Cl﹣)=0.01mol/L﹣(0.009﹣x)mol/L=(0.001+x)mol/L,故x×(0.001+x)=1.8×10﹣10 , 由于0.009×0.01=9×10﹣5>1.8×10﹣10 , 故0.001+x≈0.001,解得x≈1.8×10﹣7 ,
再向反应后的溶液中加入100mL0.001molL﹣1盐酸,不发生反应时c(Ag+)= ![]() ×1.8×10﹣7molL﹣1=9×10﹣8molL﹣1、c(Cl﹣)=
×1.8×10﹣7molL﹣1=9×10﹣8molL﹣1、c(Cl﹣)= ![]() ×[(0.001+1.8×10﹣7+0.001]molL﹣1≈0.001molL﹣1 , 而离子浓度积=0.001×9×10﹣8=0.9×10﹣10<1.8×10﹣10 , 故没有沉淀产生,
×[(0.001+1.8×10﹣7+0.001]molL﹣1≈0.001molL﹣1 , 而离子浓度积=0.001×9×10﹣8=0.9×10﹣10<1.8×10﹣10 , 故没有沉淀产生,
所以答案是:1.8×10﹣7mol/L;否.
【考点精析】根据题目的已知条件,利用反应热和焓变和化学平衡的计算的相关知识可以得到问题的答案,需要掌握在化学反应中放出或吸收的热量,通常叫反应热;反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuO | |
c | NaCl | Al(OH)3 | FeCl2 | CuSO4 |
A. A B. B C. C D. D