题目内容
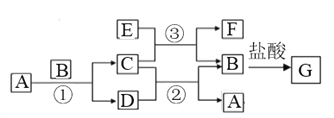
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuO | |
c | NaCl | Al(OH)3 | FeCl2 | CuSO4 |
A. A B. B C. C D. D
【答案】B
【解析】A、钠溶于水生成氢氧化钠,氢氧化钠与盐酸反应生成氯化钠,电解熔融的氯化钠生成金属钠,A不符合题意;B、铝与氧气化合生成氧化铝,氧化铝不溶于水不能直接转化为氢氧化铝,另外氢氧化铝也不能直接转化为铝,B符合题意;C、铁在氯气中燃烧生成氯化铁,氯化铁与铁反应生成氯化亚铁,氯化亚铁被锌置换生成铁,C不符合题意;D、铜与氧气化合生成氧化铜,氧化铜与稀硫酸反应生成硫酸铜,硫酸铜与铁发生置换反应生成铜,D不符合题意,答案选B。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法:2Cu+H2O |
方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法II和方法III制取Cu2O而很少用方法I,其原因是 .
(2)己知:2Cu(s)+ ![]() O2(g)=Cu2O(s)△H=﹣akJmol﹣1C(s)+
O2(g)=Cu2O(s)△H=﹣akJmol﹣1C(s)+ ![]() O2(g)=CO(s)△H=﹣bkJmol﹣1
O2(g)=CO(s)△H=﹣bkJmol﹣1
Cu(s)+ ![]() O2(g)=CuO(s)△H=﹣ckJmol﹣1
O2(g)=CuO(s)△H=﹣ckJmol﹣1
则方法I发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=kJmol﹣1 .
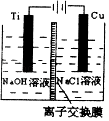
(3)方法II采用离子交换膜控制电解液中OH﹣的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为 .
(4)方法III为加热条件下用液态拼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2 . 该制法的化学方程式为 .
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: 2H2O(g) ![]() 2H2(g)+O2(g)△H>0
2H2(g)+O2(g)△H>0
水蒸气的浓度随时间t变化如表所示.
序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是(填字母代号).
A.实验温度:T1<T2
B.实验①前20min的平均反应速率v(O2)=7×10﹣5mol/(Lmin)
C.实验②比实验①所用的催化剂效率高
(6)25℃时,向50mL0.018mol/L的AgNO3溶液中加入50mL0.02mol/L盐酸,生成沉淀.若已知Ksp(AgCl)=1.8×10﹣10 , 则此时溶液中的c(Ag+