��Ŀ����
����Ŀ���̷��Ǻ���һ�����ᾧˮ�������������ڹ�ũҵ�����о�����Ҫ����;��ij��ѧ��ȤС����̷���һЩ���ʽ���̽�����ش��������⣺
��1�����Թ��м��������̷���Ʒ����ˮ�ܽ⣬�μ�����ϡ���Ὣ��Һ�ữ���μ�KSCN��Һ����Һ��ɫ�����Ա仯�������Թ���ͨ���������Һ��졣д���ù��̵��������ӷ�Ӧ����ʽ��___________________________��
��2��Ϊ�ⶨ�̷��нᾧˮ��������ʯӢ�����ܣ������˿���K1��K2������Ϊװ��A�����أ���Ϊm1 g������Ʒװ��ʯӢ�������У��ٴν�װ��A���أ���Ϊ m2 g������ͼ���Ӻ�װ�ý���ʵ�顣
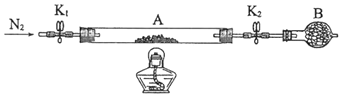
������B��������______________��
�ڽ�����ʵ�����������ȷ����_______�����ţ����ظ������������裬ֱ��A���أ���Ϊm3 g��
A����ȼ�ƾ��ƣ�����
B��Ϩ��ƾ���
C���ر�K1��K2
D����K1��K2������ͨ��N2
e.����A
f.��ȴ������
�۸���ʵ���¼�������̷���ѧʽ�нᾧˮ��Ŀx=_______________������ʽ��ʾ������ʵ��ʱ��a��d�����������ʹx__________���ƫ��ƫС������Ӱ�족����
��3���ⶨ���������ķֽ����֣�һ�ֲ���Ϊ����ɫ���壬�������ֲ���Ϊ���壬��Ӧ���������������뻹ԭ��������ʵ�����ȣ�д���ù��̵Ļ�ѧ����ʽ��________________________��
���𰸡� 4Fe2++O2+4H+=4Fe3++2H2O ��Fe3++3SCN��= Fe(SCN)3 ����� dabfce ![]() ƫС 2FeSO4
ƫС 2FeSO4![]() Fe2O3+SO2��+SO3��
Fe2O3+SO2��+SO3��
����������1�����Թ��м��������̷���Ʒ����ˮ�ܽ⣬�μ�����ϡ���Ὣ��Һ�ữ���μ�KSCN��Һ����Һ��ɫ�����Ա仯��˵����Һ��û��Fe3+�������Թ���ͨ���������Һ�����˵��������������Fe2+��O2����ΪFe3+���ù����Ⱥ����������ӷ�Ӧ�����ӷ���ʽ�ֱ�Ϊ4Fe2++O2+4H+=4Fe3++2H2O��Fe3++3SCN��= Fe(SCN)3.
��2��������B�������Ǹ���ܡ�
��ʵ�������������Ϊ����K1��K2������ͨ��N2 ���ų�ϵͳ�ڵ���������ֹ��������ʵ�飩����ȼ�ƾ��ƣ����ȣ����̷����ʧȥ�ᾧˮ����Ϩ��ƾ�������ȴ������(���ڼ����ͨ�뵪����ˮ��������ų�������֤����ʱ��������¶ȡ���ѹ��ͬ)���ر�K1��K2 ������A ������ʵ�����������ȷ����Ϊdabfce���ظ������������裬ֱ��A���أ���Ϊm3 g��
�۸���ʵ���¼��֪���̷�������Ϊ(m2-m1)g����������������Ϊ(m3-m1)g�����̷��Ļ�ѧʽΪFeSO4xH2O����![]() ����֮���̷���ѧʽ�нᾧˮ��Ŀx=
����֮���̷���ѧʽ�нᾧˮ��Ŀx=![]() ����ʵ��ʱ��a��d��������������������ᱻ�������������õ�����m3ƫ��ʹxƫС��
����ʵ��ʱ��a��d��������������������ᱻ�������������õ�����m3ƫ��ʹxƫС��
��3�������������ķֽ�����֪������ɫ����Ϊ�������������������ֱ�Ϊ�����������������Ӧ���������������뻹ԭ��������ʵ�����ȣ����Ըù��̵Ļ�ѧ����ʽΪ2FeSO4![]() Fe2O3+SO2��+SO3����
Fe2O3+SO2��+SO3����

����Ŀ������Cu2O���ھ��������Ĵ����ܶ��ܵ���ע����Ϊ��ȡCu2O�����ַ�����
������ | ��̿���ڸ��������»�ԭCuO |
������ | ��ⷨ��2Cu+H2O |
������ | ���£�N2H4����ԭ����Cu��OH��2 |
��1����ҵ�ϳ��÷���II�ͷ���III��ȡCu2O�������÷���I����ԭ���� ��
��2����֪��2Cu��s��+ ![]() O2��g��=Cu2O��s����H=��akJmol��1C��s��+
O2��g��=Cu2O��s����H=��akJmol��1C��s��+ ![]() O2��g��=CO��s����H=��bkJmol��1
O2��g��=CO��s����H=��bkJmol��1
Cu��s��+ ![]() O2��g��=CuO��s����H=��ckJmol��1
O2��g��=CuO��s����H=��ckJmol��1
��I�����ķ�Ӧ��2CuO��s��+C��s��=Cu2O��s��+CO��g����H=kJmol��1 ��
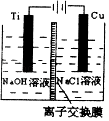
��3������II�������ӽ���Ĥ���Ƶ��Һ��OH����Ũ�ȶ��Ʊ�����Cu2O��װ����ͼ��ʾ���õ�ص�������ӦʽΪ ��
��4������IIIΪ������������Һ̬ƴ��N2H4����ԭ����Cu��OH��2���Ʊ�����Cu2O��ͬʱ�ų�N2 �� ���Ʒ��Ļ�ѧ����ʽΪ ��
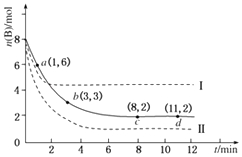
��5������ͬ���ܱ������У����������ַ����Ƶõ�Cu2O�ֱ���д��ֽ�ˮ��ʵ�飺 2H2O��g�� ![]() 2H2��g��+O2��g����H��0
2H2��g��+O2��g����H��0
ˮ������Ũ����ʱ��t�仯�����ʾ��
��� | 0 | 10 | 20 | 30 | 40 | 50 | |
�� | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
�� | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
�� | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
����������ȷ����������ĸ���ţ���
A.ʵ���¶ȣ�T1��T2
B.ʵ���ǰ20min��ƽ����Ӧ����v��O2��=7��10��5mol/��Lmin��
C.ʵ��ڱ�ʵ������õĴ���Ч�ʸ�
��6��25��ʱ����50mL0.018mol/L��AgNO3��Һ�м���50mL0.02mol/L���ᣬ���ɳ���������֪Ksp��AgCl��=1.8��10��10 �� ���ʱ��Һ�е�c��Ag+