题目内容
14.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 1 mol/L BaCl2溶液中含有的钡离子数为NA | |
| B. | 1 mol镁原子中含有的电子数为2NA | |
| C. | 常温常压下,11.2 L H2中含有的氢分子数为0.5NA | |
| D. | 16 g O3中含有的氧原子数为NA |
分析 A、溶液体积不明确;
B、镁原子的核外有12个电子;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、根据N=nNA来计算.
解答 解:A、溶液体积不明确,故溶液中钡离子的个数无法计算,故A错误;
B、镁原子的核外有12个电子,故1mol镁含有12mol电子,故B错误;
C、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氢气的物质的量小于0.5mol,故C错误;
D、16g臭氧中含有的氧原子的个数N=nNA=$\frac{16g}{16g/mol}{N}_{A}$=NA,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
4.能正确表示下列反应的离子方程式的是( )
| A. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- | |
| B. | 向石灰水中滴加少量Ca(HCO3)2溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 过氧化钠与水反应:2O22-+2H2O=4OH-+O2↑ | |
| D. | 一定量明矾溶液中滴加Ba(OH)2溶液至沉淀的质量最大时:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O |
2.燃烧氢气时耗氧量小,放出热量多,已知4g H2燃烧生成液态水时放出热量为571.6kJ,表示H2燃烧热的热化学方程式为( )
| A. | 2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | B. | 2H2(g)+O2(g)=2H2O(g)△H=-571.6kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ/mol | D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ/mol |
9.下列化学用语正确的是( )
| A. | 乙烯的结构简式是C2H4 | |
| B. | 氯离子的结构示意图: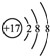 | |
| C. | NaCl的电子式是Na:Cl | |
| D. | 硫酸的电离方程式:H2SO4═H2++SO42- |
19.CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)?CH3OH,下列叙述中能说明上述反应在一定条件下一定达到最大限度的是( )
| A. | CO全部转化为乙醇 | |
| B. | 正反应和逆反应的化学反应速率均为零 | |
| C. | CO和H2以1:2的物质的量之比反应生成甲醇 | |
| D. | 反应体系中甲醇的物质的量浓度不再变化 |
6.下列物质只含有离子键的是( )
| A. | CO2 | B. | CaCl2 | C. | NH4Cl | D. | NaOH |
3.已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍,下列说法正确的是( )
| A. | X与Y形成的化合物只有一种 | |
| B. | 原子半径的大小顺序:r(R)>r(W)>r(Y) | |
| C. | 元素R的简单气态氢化物的热稳定性比W的强 | |
| D. | Y的最高价氧化物对应水化物的酸性比W的强 |