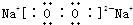题目内容
9.下列排序正确的是( )| A. | 离子半径:Cl-<S2-<As3- | B. | 碱性:Ba(OH)2<Ca(OH)2<KOH | ||
| C. | 热稳定性:HCl<HBr<HI | D. | 沸点:AsH3<PH3<NH3 |
分析 A、电子层数越多半径越大,电子层结构相同,核电荷数越大离子半径越小;
B、金属性越强,最高价氧化物对应水化物的碱性增加;
C、元素的非金属性越强,对应的氢化物的稳定性越强;
D、同一主族元素氢化物相对分子质量越大,其熔沸点越高,但含有氢键的氢化物熔沸点最高.
解答 解:A、As3-是四个电子层,S2-、Cl-三个电子层,离子电子层结构相同,核电荷数越大离子半径越小,故离子半径:As3->S2->Cl-,故A正确;
B、金属性Ba>Ca,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则KOH>Ba(OH)2>Ca(OH)2,故B错误;
C、非金属性Cl>Br>I,元素的非金属性越强,对应的氢化物的稳定性越强,所以稳定性:HCl>HBr>HI,故C错误;
D、同一主族元素氢化物相对分子质量越大,其熔沸点越高,但含有氢键的氢化物熔沸点最高,氨气中含有氢键,熔沸点最高,则熔沸点NH3>ASH3>PH3,故D错误;
故选A.
点评 本题考查元素周期律的递变规律,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握元素的递变规律以及与对应单质、化合物的性质的关系以及比较角度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.在水溶液中能大量共存的离子组是( )
| A. | Al3+ H+ HCO3- | B. | Na+ NO3- Cl- | C. | H+ OH- SO42- | D. | Ca2+ K+ CO32- |
20.下列反应中,既是离子反应,又是氧化还原反应的是( )
| A. | CaCO3+HCl | B. | Ag NO3+NaCl | C. | Fe+CuSO4 | D. | NaOH+H2SO4 |
14.有Na2SO4和Fe2(SO4)3的混合液,已知其中Fe3+的物质的量浓度为0.8mol/L,SO42-的物质的量浓度为1.4mol/L,则此溶液中Na+的物质的量浓度为( )
| A. | 0.4 mol/L | B. | 0.2 mol/L | C. | 0.25 mol/L | D. | 0.3 mol/L |
1.做焰色反应实验的铂丝应用( )
| A. | 硫酸洗涤 | B. | 稀盐酸洗涤 | C. | 水洗涤 | D. | 醋酸洗涤 |
19.下列说法中正确的是( )
| A. | 常温下,浓硫酸、浓硝酸均能将金属铜氧化,且均能使铁钝化 | |
| B. | 乙烯常用作植物催熟剂,乙酸常用作调味剂,乙醇常用于杀菌消毒 | |
| C. | 玛瑙、水晶、钻石的主要成分均为SiO2 | |
| D. | 用CCl4萃取碘水中的I2时,紫色溶液从分液漏斗的上口倒出 |