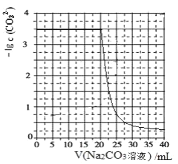
题目内容
【题目】关于下列装置的说法正确的是
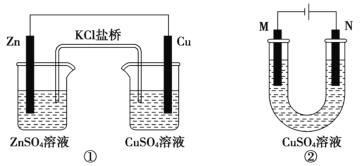
A.装置①将电能转变为化学能
B.装置①中盐桥内的 K+移向 CuSO4 溶液
C.若装置②用于铁棒镀铜,则 N 极为铁棒
D.若装置②用于电解精炼铜,溶液中的 Cu2+浓度保持不变
【答案】B
【解析】
A.装置①为有盐桥的铜锌原电池装置,能将化学能转化为电能,故A错误;
B.装置①中锌为负极,铜为正极,根据原电池原理,电解质溶液中的阳离子移向正极,所以盐桥内的 K+移向CuSO4溶液,故B正确;
C.若装置②用于铁棒镀铜,则应将铁棒与电源的负极相连作阴极,所以M极为铁棒,故C错误;
D.若装置②用于电解精炼铜,因为粗铜中会有其他金属单质放电生成金属阳离子,所以溶液中的 Cu2+浓度会降低,故D错误;
综上所述,答案为B。

 阅读快车系列答案
阅读快车系列答案【题目】“绿水青山就是金山银山”。目前人们对环境保护、新能源开发很重视,研究NO2、NO、CO、SO2等大气污染物转化为能参与大气循环的物质,对建设美丽中国具有重要意义。
(1)有人设计通过硫循环完成CO的综合处理,原理为
a.2CO(g)+SO2(g)![]() S(l)+2CO2(g) △H1= - 37.4kJ·mol-1
S(l)+2CO2(g) △H1= - 37.4kJ·mol-1
b.S(l)+2H2O(g)![]() 2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
则CO和水蒸气完全反应生成H2和CO2的热化学方程式为__________________________________。
(2)CO可在一定条件下转化为CH3OH。已知:向2L密闭容器中通入2 molCO和4molH2,在适合的催化剂和T1温度下,发生反应CO(g)+2H2(g)![]() CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
反应时间 | CO(mol) | H2(mol) | CH3OH(mol) |
0min | 2 | 4 | 0 |
10min | 2 | ||
20min | 0.2 |
①前10min内的平均反应速率v(CO)= _______;在20min时,温度T2下,该反应的化学平衡常数为________________。
②若30min时升高温度,化学平衡常数值_______(填:“增大“减小”“不变”)。
③在T1温度下,既能增大反应速率和提高CO平衡转化率的措施有_____________(填两种措施即可)
④在恒温恒容下,下列可以判断CO(g)+2H2(g)![]() CH3OH(g)反应达到平衡状态的________(填序号)。
CH3OH(g)反应达到平衡状态的________(填序号)。
a.2v正(H2)=v逆(CH3OH) b.混合气体的物质的量不再变化
c.单位时间内有1 mol CO消耗同时消耗2molH2 d.混合气体的平均相对分子质量不变
(3)已知反应2NO(g)+O2(g)![]() 2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
组别 | 起始浓度/mol·L-1 | 初始速率/ mol·L-1·S-1 | |
NO | O2 | ||
1 | 0.02 | 0.0125 | 7.98×10-3 |
2 | 0.02 | 0.0250 | 15.96×10-3 |
3 | 0.04 | 0.0125 | 31.92×10-3 |
则k1=____, m =_____, n =_____。
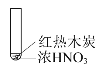
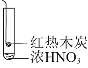
【题目】下述实验中均有红棕色气体产生,对比分析所得结论正确的是( )
① | ② | ③ |
|
|
|
A.由①中的红棕色气体,可推知反应还有氧气产生
B.红棕色气体表明②中木炭与浓硝酸发生了反应
C.由③可说明浓硝酸具有挥发性和强氧化性
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应