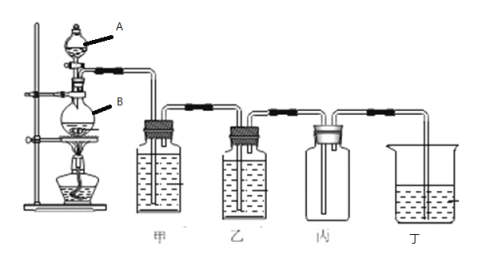
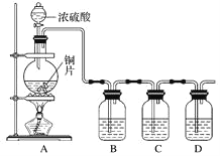
题目内容
【题目】某新型电池比传统电池有更长的循环寿命和功率密度,其工作原理如图所示。下列有关该电池的说法正确的是
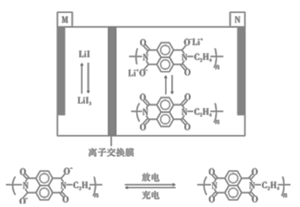
A.充电时N电极上发生氧化反应
B.放电时M极的电极反应式为3I--2e-=I3-
C.充电时Li+通过离子交换膜从M池进入N池
D.放电时每当有2 mole-转移时生成1 mol 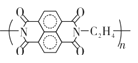
【答案】C
【解析】
分析工作原理图和题给信息,可知:放电时,N极物质失去电子,发生氧化反应,则N极为负极,M极为正极,充电时,N极物质得到电子,发生还原反应,N极为阴极,则M极为阳极,据此进行分析。
A.由题中N极物质充放电时的物质转化可知,充电时,N极发生还原反应,A项错误;
B.放电时,M极为正极,得到电子,发生还原反应,电极反应方程式为:I3-+2e-=3I-,B项错误;
C.由分析可知,充电时N极为阴极,M极为阳极,则根据电解池原理,阳离子向阴极移动,可知Li+通过离子交换膜从M池进入N池,C项正确;
D.由题可知,放电时每当有2mole-转移时生成![]() mol
mol  ,D项错误;
,D项错误;
答案选C。

【题目】大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)之后才能排放。
(1)CO和H2可作为能源和化工原料,应用十分广泛。 反应CO(g)+H2O(g) ![]() H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为________。
(2)在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1
2CO2(g) ΔH=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+180.5 kJ·mol1
2NO(g) ΔH=+180.5 kJ·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ·mol1
2NO2(g) ΔH=116.5 kJ·mol1
回答下列问题:
①CO的燃烧热为 _________。 若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为_________kJ。
②写出CO将NO2还原为单质反应的热化学方程式为__________________________________________
(3)汽车排气管上的催化转化器,发生上述的CO将NO2还原为单质反应。在一定温度下,将一定量的CO和NO2充入2L固定容积的容器中,回答以下问题:
①从反应开始到5min,生成了0.08mol N2,则5min内υ(CO)=___________________molL1min1。
②25min时,物质浓度变化如图所示,则改变的条件可能是___________(填字母标号)。
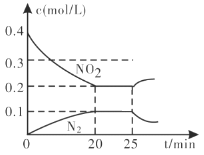
A.缩小容器体积 B.增加NO2的浓度 C.降低温度 D.升高温度
【题目】中共十九大报告指出,加快水污染防治、实施流域环境和近岸海域综合治理、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。在适当的条件下,将CO2转化为甲醇、甲醚等有机物,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
(1)已知:①2H2(g)+O2(g)=2H2O(g) ΔH1=484 kJ/mol
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
则2CH3OH(g)+3O2(g)= 2CO2(g)+4H2O(g) ΔH,ΔH=____。
(2)已知T K时,某恒容密闭容器中存在如下反应:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如表所示:
CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如表所示:
c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | |
开始时 | a | b | 0 | 0 |
10 s时 | 3 | 0.5 | c | 1.5 |
①若反应开始到10s时间段内,v(H2)=____。
②若TK时,化学平衡常数K=15,则10s时v(正)___v(逆)(填“>”“<”或“=”),此时CO2的转化率为____。
(3)一定条件下,向某恒容密闭容器中充入x mol CO2和ymolH2,发生的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为___(填“a”或“b”)。
CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为___(填“a”或“b”)。