题目内容
【题目】高能锂离子电池总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法正确的是
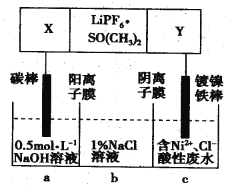
A. LiPF6·SO(CH3)2可用Li2SO4水溶液代替
B. 当转移1mol e-时,b室离子数增加NA个
C. 该电池充电时阳极反应式为Fe+Li2S-2e-=FeS+2Li+
D. 若去除图阴离子膜,则电解反应总方程式发生改变
【答案】C
【解析】
A. Li是活泼金属可与水反应,故A不正确;
B. 当转移1mol e-时,b室中从a过来1molNa+,从b过来1molCl-,离子数应该增加2NA个,故B不正确;
C.该电池充电时阳极反应式是正极反应的逆反应,故C正确;
D.若去除图阴离子膜,则电解反应总方程式不会发生改变,依然是阳极氢氧根离子失电子,阴极镍离子得电子,故D不正确;
正确答案:C。

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:


可能用到的有关数据如下:
相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是________。
(2)加入碎瓷片的作用是_____________________________________________________;
如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填字母,下同)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为____________________________________。
(4)分液漏斗在使用前须清洗干净并_____;在本实验分离过程中,产物应该从分液漏斗的_____(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是______________________________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________。
A.接收器 B.温度计 C.吸滤瓶 D.球形冷凝管
(7)本实验所得到的环己烯产率是________。
A.41% B.50% C.61% D.70%



