题目内容
【题目】氮的化合物应用广泛,但氮氧化物是重要的空气污染物,应降低其排放。
(1)用CO2和NH3可合成氮肥尿素[CO(NH3)2]
已知:①2NH3(g)+CO2(g)=NH2CO2NH4 (s) △H=-159.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
③H2O(l)=H2O(g) △H=+44 kJ·mol-1
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为______________。
(2)工业上常用如下反应消除氮氧化物的污染:
CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H
N2(g)+CO2(g)+2H2O(g) △H
在温度为T1和T2时,分别将0.40molCH4和1.0molNO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如右图所示:
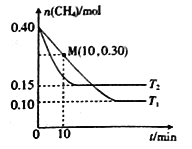
①根据右图判断该反应的△H________0(填“>”、“<”或“=”),理由是______________。
②温度为T1时,0~10min内NO2的平均反应速率v(NO2)=__________,反应的平衡常数K=___(保留三位小数)
③该反应达到平衡后,为在提高反应速率同时提高NO2的转化率,可采取的措施有______(填标号)。
A.改用高效催化剂 B.升高温度
C.缩小容器的体积 D.增加CH4的浓度
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH________(填“增大”、“减小”或“不变”),负极的电极反应式为___________________。
(4)氮的一种氢化物HN3,其水溶液酸性与醋酸相似,则NaN3溶液中各离子浓度由大到小的顺序为________;常温下,将amol·L-1 的HN3与bmol·L-1 的Ba(OH) 2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N3-),则该混合物溶液呈_______(填“酸”、“碱”或“中”)性,溶液中c(HN3)=_________ mol·L-1。
【答案】 2NH3(g) +CO2(g)=CO(NH2)2(s)+ H2O (l) < T1<T2,T2时CH4的平衡含量高,说明升高温度,化学平衡向逆反应方向移动,逆反应为吸热反应 0.02 mol ·L-1·min-1 2.025 D 增大 2NH3-6e-+6OH-=N2 + 6H2O c(Na+)>c(N3﹣)>c(OH-)>c(H+) 中 (![]() -b)
-b)
【解析】(1)本题考查盖斯定律的应用,目标反应是CO2+2NH3=CO(NH2)2+H2O,即①+②-③得出2NH3(g) +CO2(g)=CO(NH2)2(s)+ H2O (l) ;(2)考查影响化学平衡移动的因素、化学反应速率的计算和化学平衡常数的计算,①先达到平衡说明反应速率快,即T2>T1,随着温度的升高,甲烷的物质的量增加,说明升高温度,平衡向逆反应方向移动,即正反应方向△H<0;②前10s,消耗甲烷的物质的量为(0.4-0.3)mol=0.1mol,即消耗NO2的物质的量为2×0.1mol=0.2mol,根据化学反应速率的表达式,v(NO2)=0.2/(1×10)mol/(L·min)=0.02 mol/(L·min), CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)
起始(mol·L-1)0.4 1 0 0 0
变化: 0.3 0.6 0.3 0.3 0.6
平衡: 0.1 0.4 0.3 0.3 0.6 根据化学平衡常数的定义,K=[c2(H2O)×c(CO2)×c(N2)]/[c2(NO2)×C(CH4)]=(0.62×0.3×0.3)/(0.42×0.1)=2.025;③A、使用催化剂,只加快反应速率,对化学平衡无影响,故A错误;B、正反应方向是放热反应,升高温度平衡向逆反应方向移动,NO2的转化率降低,但化学反应速率加快,故B错误;C、缩小容器的体积,增大压强,平衡向逆反应方向进行,NO2的转化率降低,但反应速率加快,故C错误;D、增加CH4的浓度,平衡向正反应方向移动,NO2的转化率增大,化学反应速率加快,故D正确;(3)本题考查电极反应式的书写,正极上发生还原反应,化合价降低,应是NO2参与反应,因此正极反应式为2NO2+4H2O+8e-=N2+8OH-,c(OH-)增大,pH增大;根据电池反应,负极反应式为2NH3-6e-+6OH-=N2 + 6H2O ;(4)醋酸属于弱酸,HN3也属于弱酸,因此N3-发生水解反应,溶液显碱性,但水解程度微弱,即离子浓度大小顺序是 c(Na+)>c(N3﹣)>c(OH-)>c(H+);根据溶液显电中性,即有2c(Ba2+)+c(H+)=c(OH-)+c(N3-),因为2c(Ba2+)=c(N3-),因此c(OH-)=c(H+),溶液显中性;反应后溶液的溶质为Ba(N3)2和HN3,假设溶液体积为1L,则Ba(N3)2的物质的量为bmol,则HN3的物质的量(a-2b)mol,即c(HN3)=(a-2b)2mol·L-1。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案