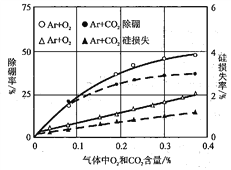
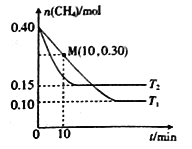
题目内容
【题目】某化学学习小组在实验室模拟工业法制取Br2,装置如图所示。

(1)仪器M的名称是________。
(2)实验室制取Cl2在通入装置A之前_______(填“需要”或“不需要”)除杂。
(3)实验前检査装置气密性的方法是_______________。
(4)反应过程中Br2在装置B中与Na2CO3反应生成NaBr和NaBrO3。为使装置A中产生的Br2尽可能被吸收,可采取的合理措施是_____________。
(5)反应结束后,取下装置B,向装置B中加入稀H2SO4会生成Br2,该反应的离子方程式为______________。
【答案】
(1)烧杯;
(2)不需要;
(3)关闭K1,打开K2,在烧杯C中加入适量水,将导管末端浸入水中,缓慢鼓动气,观察导管末端有没有气泡产生;
(4)通过气唧,缓慢鼓入空气;
(5)6H++5Br-+BrO3-=3Br2+3H2O;
【解析】
试题分析:(1)根据装置图,仪器M是烧杯,故答案为:烧杯;
(2)实验室制取的Cl2中含有氯化氢和水蒸气,氯化氢和水蒸气对实验无影响,通入装置A之前不需要除去,故答案为:不需要;
(3)实验前检査装置气密性的方法是关闭K1,打开K2,在烧杯C中加入适量水,将导管末端浸入水中,缓慢鼓动气,观察导管末端有没有气泡产生,故答案为:关闭K1,打开K2,在烧杯C中加入适量水,将导管末端浸入水中,缓慢鼓动气,观察导管末端有没有气泡产生;
(4)溴容易挥发,为使装置A中产生的Br2尽可能被吸收,可采取的合理措施是通过气唧,缓慢鼓入空气,故答案为:通过气唧,缓慢鼓入空气;
(5)向装置B中加入稀H2SO4,NaBr和NaBrO3发生氧化还原反应生成Br2,反应的离子方程式为6H+ +5Br- +BrO3-=3Br2+3H2O,故答案为:6H+ +5Br- +BrO3-=3Br2+3H2O。

 阅读快车系列答案
阅读快车系列答案