题目内容
【题目】Ⅰ、依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示,
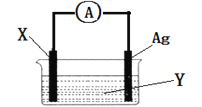
(1)电极X的材料是________________;
电解质溶液Y是_________________;
(2)银电极为电池的______极,发生的电极反应为____________;X电极上发生的电极反应为________________;
(3)外电路中的电子是从____电极流向_____电极。(用电极材料名称作答)
若原来两电极棒质量相等,则当电路中通过0.2mol电子时,两个电极的质量差为__g。
Ⅱ、在一密闭容器中发生反应N2+3H2![]() 2NH3,正反应为放热反应,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
2NH3,正反应为放热反应,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
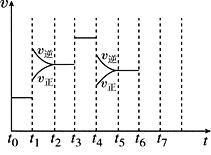
(1)处于平衡状态的时间段是______________(填选项)。
A.t0~t1 B.t1~t2 C.t2~t3
D.t3~t4 E.t4~t5 F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是
t1时刻__________;t3时刻_______;t4时刻_______。
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是_______(填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。_____
(5)合成氨反应起始只投氮气和氢气,一定条件下,反应达到化学平衡状态时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为_________。
【答案】 铜 AgNO3溶液 正 2Ag++2e-→2Ag Cu→Cu2++2e- 铜 银 28.0g A、C、D、F C E B A  6:5
6:5
【解析】Ⅰ、(1)由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,Ag+在正极上得电子被还原,电解质溶液为AgNO3 (2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e-=Ag;X电极上发生的电极反应为Cu→Cu2++2e-;(3)外电路中的电子是从铜电极流向银电极。若刚开始Cu电极和银电极的质量相等,当电路中通过0.2mol电子时,正极上生成Ag为0.2mol,即21.6g,负极上Cu溶解的物质的量为0.1mol,即6.4g,所以两个电极的质量差为28.0g
Ⅱ、:(1)根据图示可知,t0~t1、t2~t3、t3~t4、t5~t6时间段内,v正、v逆相等,反应处于平衡状态,故答案为:ACDF;(2)由N2(g)+3H2(g)2NH3(g)△H<0,可知,该反应为放热反应,且为气体体积减小的反应,则由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率,改变条件应为升高温度;t3时正逆反应速率均增大,且逆反应速率等于正反应速率,改变条件应为加催化剂; t4时,正逆反应速率均减小,且逆反应速率大于正反应速率,平衡逆向移动,改变条件应为减小压强;答案为C、E、B;(3)由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,均使氨气的含量减少,则t0~t1氨气的含量最大,故选A;(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。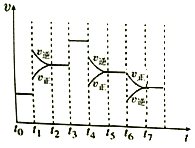 ;
;
(5)设反应前加入a mol N2,b mol H2,达平衡时生成2x mol NH3,
N2(g)+3H2(g)2NH3(g)
起始 a b 0
转化 x 3x2x
平衡 a-x b-3x 2x
则反应后气体总的物质的量=(a+b-2x)mol![]() ,解得:a+b=12x,故反应后与反应前的混合气体体积之比=
,解得:a+b=12x,故反应后与反应前的混合气体体积之比=![]() 。
。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案【题目】《化学与生活》模块试题
(1)我国农业因遭受酸雨而造成的损失每年高达15亿多元,酸雨是指pH小于________的雨水,这主要是由人为排放的_______和________(填元素名称)的氧化物等酸性气体转化而成的。为治理酸雨的影响,可将CaCO3粉末撒到受酸雨影响的湖泊中,若用离子方程式表示该反应的本质,请完成如下离子反应:CaCO3+2H+==_____________________________。
主食 | 米饭 |
副食 | 红烧鱼 |
饮品 | 豆浆 |
配菜 | ? |
(2)“民以食为天”,人类生命活动所需的各种营养物质主要来自食物。上表制定的食谱中,主食含有的基本营养物质主要是__________,副食含有的基本营养物质主要是_____________;豆浆所属的分散系为__________________。考虑营养成分的均衡搭配,应补充的配菜是__________________。
(3)水是一种宝贵的自然资源。
①生活污水中,经常包括含__________、___________(填元素符号)的化合物,会造成水体植物营养物质污染。水中的氨在微生物的作用下,可被氧化成HNO2,进而氧化成HNO3,写出这一过程的化学方程式____________________________。
②氧化还原法是处理污水常用的方法。某地工厂排放的污水,经检测,污水中含有0.012 mol/L的游离溴,可用Na2SO3还原除去污水中的溴,请写出其化学方程式:___________________________;处理5 L这种污水,至少需加入0.05 mol/L的 Na2SO3 溶液________L才能将溴全部除去。