题目内容
【题目】高锰酸钾是常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。中间产物为锰酸钾。下图是实验室模拟制备KMnO4晶体的操作流程:

已知:锰酸钾(K2MnO4)是墨绿色晶体,其水溶液呈深绿色,这是锰酸根离子(MnO42-)在水溶液中的特征颜色,在强碱性溶液中能稳定存在;在酸性、中性和弱碱性环境下,MnO42-会发生自身氧化还原反应,生成MnO4-和MnO2。
回答下列问题:
(1)KOH的电子式为______,煅烧KOH和软锰矿的混合物应放在_______中加热(填标号)。
a.烧杯 b.瓷坩埚 c.蒸发皿 d.铁坩埚
(2)调节溶液pH过程中,所得氧化产物与还原产物的物质的量之比为______。
(3)趁热过滤的目的是_______________________________。
(4)已知20℃时K2SO4、KCl、CH3COOK的溶解度分别为11.1g、34g、217g,则从理论上分析,选用下列酸中__________(填标号),得到的高锰酸钾晶体纯度更高。
a.稀硫酸 b.浓盐酸 c.醋酸 d.稀盐酸
(5)产品中KMnO4的定量分析:
①配制浓度为0.1250mg·mL-1的KMnO4标准溶液100mL。
②将上述溶液稀释为浓度分别为2.5、5.0、7.5、10.0、12.5、15.0(单位:mg·L-1)的溶液,分别测定不同浓度溶液对光的吸收程度,并将测定结果绘制成曲线如下。
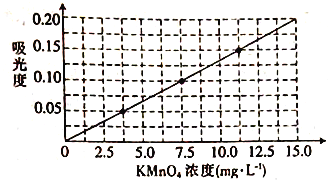
③称取KMnO4样品(不含K2MnO4)0.1250g按步骤①配得产品溶液1000mL,取10mL稀释至100mL,然后按步骤②的方法进行测定,两次测定所得的吸光度分别为0.149、0.151,则样品中KMnO4的质量分数为____。
(6)酸性KMnO4溶液与FeSO4溶液反应的离子方程式为_______________________。
【答案】 ![]() d 2∶1 防止析出高锰酸钾,降低产率 c 90.0% MnO4-+5Fe2++8H+ =Mn2++5Fe3++4H2O
d 2∶1 防止析出高锰酸钾,降低产率 c 90.0% MnO4-+5Fe2++8H+ =Mn2++5Fe3++4H2O
【解析】(1)本题考查电子式的书写和仪器的选择,KOH属于离子化合物,其电子式为![]() ,因为是煅烧,烧杯和蒸发皿的不耐高温,因此选项ac错误,瓷坩埚成分是SiO2,SiO2在高温下与KOH反应 ,因此不能用瓷坩埚,因此选项d正确;(3)考查氧化还原反应中得失电子数目守恒,根据信息,锰酸钾在酸性、中性、弱碱性环境中发生歧化反应,MnO2是锰酸钾中Mn由+6价→+4价,化合价降低得到,因此MnO2是还原产物,KMnO4是氧化产物,n(KMnO4)×1=n(MnO2)×2,得出n(KMnO4):n(MnO2)=2:1;(3)考查物质的分离,高锰酸钾溶于水,MnO2不溶于水,因此趁热过滤目的是防止析出高锰酸钾,降低产率;(4)考查物质的分离和提纯,高锰酸钾与浓盐酸反应,因此选项b错误;然后根据三种物质的溶解度大小,溶解度越大,得到高锰酸钾纯度越高,故选项c正确;(5)③考查化学计算,吸光度的平均值为(0.149+0.151)/2=0.150,此时对应的KMnO4的浓度为11.25mg·L-1,则1000mL的溶液中KMnO4的浓度为11.25×1000/100mg·L-1=112.5mg·L-1,因此高锰酸钾的质量分数为112.5/(0.1250×103)×100%=90.0%;(6)本题考查氧化还原反应方程式的书写,利用高锰酸钾的氧化性,把Fe2+氧化成Fe3+,本身被还原成Mn2+,然后根据化合价的升降法进行配平,即离子反应方程式为MnO4-+5Fe2++8H+ =Mn2++5Fe3++4H2O。
,因为是煅烧,烧杯和蒸发皿的不耐高温,因此选项ac错误,瓷坩埚成分是SiO2,SiO2在高温下与KOH反应 ,因此不能用瓷坩埚,因此选项d正确;(3)考查氧化还原反应中得失电子数目守恒,根据信息,锰酸钾在酸性、中性、弱碱性环境中发生歧化反应,MnO2是锰酸钾中Mn由+6价→+4价,化合价降低得到,因此MnO2是还原产物,KMnO4是氧化产物,n(KMnO4)×1=n(MnO2)×2,得出n(KMnO4):n(MnO2)=2:1;(3)考查物质的分离,高锰酸钾溶于水,MnO2不溶于水,因此趁热过滤目的是防止析出高锰酸钾,降低产率;(4)考查物质的分离和提纯,高锰酸钾与浓盐酸反应,因此选项b错误;然后根据三种物质的溶解度大小,溶解度越大,得到高锰酸钾纯度越高,故选项c正确;(5)③考查化学计算,吸光度的平均值为(0.149+0.151)/2=0.150,此时对应的KMnO4的浓度为11.25mg·L-1,则1000mL的溶液中KMnO4的浓度为11.25×1000/100mg·L-1=112.5mg·L-1,因此高锰酸钾的质量分数为112.5/(0.1250×103)×100%=90.0%;(6)本题考查氧化还原反应方程式的书写,利用高锰酸钾的氧化性,把Fe2+氧化成Fe3+,本身被还原成Mn2+,然后根据化合价的升降法进行配平,即离子反应方程式为MnO4-+5Fe2++8H+ =Mn2++5Fe3++4H2O。

【题目】一定条件下进行反应:COCl2(g) ![]() Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),反应过程中测得的有关数据见下表:
Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法不正确的是( )
A. 使用恰当的催化剂能加快该反应速率
B. 该条件下,COCl2的最大转化率为60%
C. 6s时,反应达到最大限度即化学平衡状态
D. 生成Cl2的平均反应速率,0~2s比2~4s快