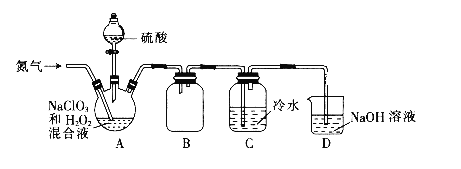
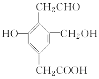
题目内容
【题目】元素周期表短周期中六种元素的原子序数与主要化合价的关系如图:
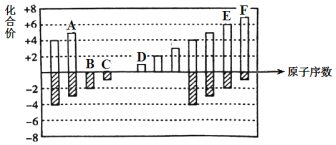
(1)E在元素周期表中的位置是_________。
(2)C、D、F原子半径由大到小的顺序是____________(填元素符号)。
(3)A、B、C的单质与氢气反应剧烈程度由强到弱的顺序____________.(用单质的化学 式表示)。
(4)应用元素周期律和元素周期表的知识,写出D和E形成的化合物的化学式_________、________(写2种)。
(5)判断F的单质和E的最简单氢化物之间能否发生反应,若能则写出反应的化学方程式,若不能则说明理由________
【答案】第3周期VIA族 Na>Cl>F F2>O2>N2 Na2S Na2S2等 Cl2+H2S= S+2HCl
【解析】
由图知A、B、C、D、E、F的原子序数依次增大,其中B的化合价为-2价,E的化合价为-2、+6价,则B、E同主族,分别为氧元素、硫元素,C的化合价为-1价,F的化合价为-1、+7价,则C、F同主族,分别为氟元素、氯元素,A的化合价为-3、+5价,则A为氮元素、D的化合价为+1价,则D为钠元素,综上,A为氮、B为氧、C为氟、D为钠、E为硫、F为氯,据此回答;
(1)E为硫,在元素周期表中的位置是第3周期VIA族;答案为:第3周期VIA族;
(2)C、D、F分别为氟、钠、氯, Na和Cl位于同周期,钠原子半径大,F和Cl位于同主族,氯原子半径大,则原子半径由大到小的顺序是Na>Cl>F;答案为:Na>Cl>F;
(3) A为氮、B为氧、C为氟,非金属性F>O>N,元素的非金属性越强,它的单质越容易与氢气反应形成气态氢化物,反应越剧烈,则A、B、C的单质与氢气反应剧烈程度由强到弱的顺序为:F2>O2>N2;答案为:F2>O2>N2;
(4) D为钠、E为硫,D和E形成的化合物的化学式为:Na2S;Na2S2等;答案为:Na2S;Na2S2等;
(5) E为硫、F为氯,非金属性Cl>S,则 F的单质和E的最简单氢化物之间即Cl2+H2S能发生反应化学方程式为:Cl2+H2S= S+2HCl。答案为:Cl2+H2S= S+2HCl。

 应用题作业本系列答案
应用题作业本系列答案【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+===Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+===Cu+2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应至中性2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和碘单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
A. A B. B C. C D. D
【题目】已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)在酸浸过程中会适当增大酸的浓度并不断快速搅拌,目的是______________。
(2)写出“沉镍”时发生反应的离子方程式:______________________________,当Ca2+沉淀完全时,溶液中 c(F-)> ________mol·L-1(写出计算式即可)。
(3)试剂a是一种绿色氧化剂,写出“氧化”时反应的化学反应方程式:_______________________________。
(4)操作a的内容包括过滤,洗涤,干燥。请用简洁语言描述洗涤的方法是__________________________。
(5)“调pH”时pH的调控范围为______≤PH<6.8。