题目内容
【题目】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
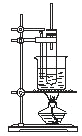
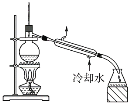
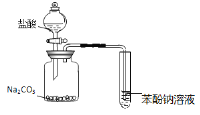
(1)某小组设计了如下图所示的实验装置用于制备ClO2。
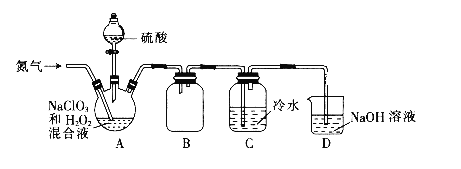
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是__________。
②装置B的作用是_________。
③当看到装置C中导管液面上升时应进行的操作是________。
(2)用0.1000mol·L-1的Na2S2O3标准液测定装置C中ClO2溶液的浓度。原理:2ClO2+10I-+8H+=5I2+2Cl-+4H2O , I2+2S2O32- = 2I- +S4O62-
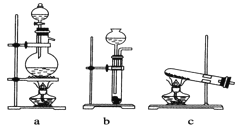
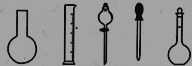
①配制0.1000molL-1的Na2S2O3标准溶液时所需仪器除在如图所示的仪器中进行选择外,还需用到的玻璃仪器是________(填仪器名称)
②在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度___0.1000molL-1(填“>”、“<”或“=”,下同);若Na2S2O3标准溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度___0.1000molL-1。
③取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入___________作指示剂,测得标准液消耗的体积为20.00mL,通过计算可知C中ClO2溶液的浓度为________ mol·L-1。
【答案】稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸 防止倒吸(或作安全瓶) 加大氮气的通入量 烧杯、玻璃棒 < < 淀粉溶液 0.04
【解析】
(1)NaClO3和H2O2混合液在装置A中发生反应制取ClO2,B是安全瓶,防止倒吸,C中的冷水用来吸收ClO2,D中的NaOH溶液进行尾气处理。
(2)用酸碱中和滴定的原理进行氧化还原滴定。先配制0.1000mol/L的Na2S2O3标准溶液,根据配制步骤确定所需仪器,根据c=![]() 确定配制的溶液浓度偏高还是偏低;用方程式计算ClO2的浓度。
确定配制的溶液浓度偏高还是偏低;用方程式计算ClO2的浓度。
(1)①由于ClO2在混合气体中的体积分数大于10%就可能发生爆炸,所以通入氮气除了可以起到搅拌作用外,还起到了稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸的作用。
②装置B的作用是作安全瓶,防止倒吸。
③若发生倒吸,即看到装置C中导管液面上升时,应加大氮气的通入量。
(2)①用固体溶质配制一定物质的量浓度的溶液所需的玻璃仪器有容量瓶、烧杯、玻璃棒、胶头滴管,图示中有容量瓶和胶头滴管,缺少的玻璃仪器是烧杯、玻璃棒。
②根据c=![]() ,若定容时仰视刻度线,会使溶液体积偏大,则所得溶液浓度<0.1000molL-1;若Na2S2O3标准溶液在转移至容量瓶时,洒落了少许,使溶质的物质的量变小,则所得溶液浓度<0.1000molL-1。
,若定容时仰视刻度线,会使溶液体积偏大,则所得溶液浓度<0.1000molL-1;若Na2S2O3标准溶液在转移至容量瓶时,洒落了少许,使溶质的物质的量变小,则所得溶液浓度<0.1000molL-1。
③根据反应2ClO2+10I-+8H+=5I2+2Cl-+4H2O ,I2+2S2O32- = 2I- +S4O62-,可找到关系:2ClO2~5I2 ~10S2O32-,即n(ClO2)=![]() =
=![]() =4.000×10-4mol,浓度为c=
=4.000×10-4mol,浓度为c=![]() =
=![]() =0.04mol/L。
=0.04mol/L。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案