题目内容
【题目】已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)在酸浸过程中会适当增大酸的浓度并不断快速搅拌,目的是______________。
(2)写出“沉镍”时发生反应的离子方程式:______________________________,当Ca2+沉淀完全时,溶液中 c(F-)> ________mol·L-1(写出计算式即可)。
(3)试剂a是一种绿色氧化剂,写出“氧化”时反应的化学反应方程式:_______________________________。
(4)操作a的内容包括过滤,洗涤,干燥。请用简洁语言描述洗涤的方法是__________________________。
(5)“调pH”时pH的调控范围为______≤PH<6.8。
【答案】提高“酸浸”速率 Ni2++C2O42-+2H2O=![]()
![]() 2FeSO4+H2SO4+H2O2=Fe2(SO4)3+2H2O 过滤结束后,沿玻璃棒往漏斗中注水至淹没沉淀待水自然流下,重复操作2-3次 5.0
2FeSO4+H2SO4+H2O2=Fe2(SO4)3+2H2O 过滤结束后,沿玻璃棒往漏斗中注水至淹没沉淀待水自然流下,重复操作2-3次 5.0
【解析】
废镍催化剂(成分主要为Ni,含有一定量的Al2O3、Fe、SiO2、CaO等),用硫酸溶解,SiO2不与硫酸反应,过滤得到滤液中含有NiSO4、FeSO4、Al2(SO4)3、CaSO4及过量的硫酸;试剂a是一种绿色氧化剂,a是H2O2, H2O2将Fe2+氧化为Fe3+,加入Ni(OH)2调节pH,使pH大于5.0小于6.8,Fe3+转化为Fe(OH)3沉淀、Al3+转化为Al)OH)3沉淀,过滤除去,滤液中含有NiSO4、CaSO4,向滤液中加入NH4F,除去Ca2+,过滤,再向滤液中加入(NH4)2C2O4,得到草酸镍沉淀,再过滤、洗涤、干燥得草酸镍晶体,据此答题。
(1)根据影响化学反应速率的因素可知,适当增大酸的浓度并不断快速搅拌,可提高浸出率;
(2)向NiSO4溶液中加入(NH4)2C2O4,得到草酸镍沉淀,“沉镍”时反应的离子方程式为:Ni2++C2O42-+2H2O=![]() ,当Ca2+沉淀完全时,Ca2+的浓度小于1.0×10-5 mol·L-1,根据氟化钙的溶度积常数,溶液中 c(F-)>
,当Ca2+沉淀完全时,Ca2+的浓度小于1.0×10-5 mol·L-1,根据氟化钙的溶度积常数,溶液中 c(F-)>![]() ;
;
(3)试剂a是一种绿色氧化剂,所以加入的a是H2O2,亚铁离子被氧化成铁离子,所以“氧化”时反应的化学反应方程式为2FeSO4+H2SO4+H2O2=Fe2(SO4)3+2H2O;
(4)操作a的内容包括过滤,洗涤,干燥。洗涤沉淀的方法是过滤结束后,沿玻璃棒往漏斗中注水至淹没沉淀待水自然流下,重复操作2-3次;
(5)根据表中的数据可知,pH为5.0时,Fe3+、Al3+沉淀完全,pH为6.8时Ni2+开始沉淀,所以pH的调控范围为5.0≤PH<6.8。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
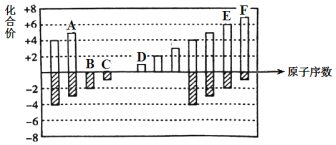
同步拓展阅读系列答案【题目】在20L的密闭容器中按物质的量之比1∶2充入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g) ΔH。测得CO的转化率随温度的变化及不同压强下CO的变化如图所示,p2和195℃时n(H2)随时间的变化结果如下表所示。下列说法正确的是( )
CH3OH(g) ΔH。测得CO的转化率随温度的变化及不同压强下CO的变化如图所示,p2和195℃时n(H2)随时间的变化结果如下表所示。下列说法正确的是( )
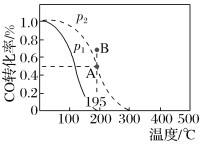
p2和195℃时n(H2)
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 5 | 4 | 4 |
A.p2和195℃时,0~3min,反应速率v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
B.p1<p2,ΔH>0
C.在p2和195℃时,该反应的平衡常数为25
D.195℃、p2时,在B点:v正>v逆
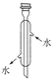
【题目】下列有关仪器的名称、图形、用途与使用操作的叙述均正确的是( )
选项 | A | B | C | D |
名称 | 250 mL容量瓶 | 分液漏斗 | 酸式滴定管 | 冷凝管 |
图形 |
|
|
|
|
用途与使用操作 | 配制1.0 mol·L-1NaCl溶液,定容时俯视刻度,则配得的溶液浓度小于1.0 mol·L-1 | 用甘油萃取碘水中的碘,分液时,碘层需从上口放出 | 可用于量取10.00mL 新制氯水溶液 | 蒸馏实验中将蒸气冷凝为液体 |
A.AB.BC.CD.D