��Ŀ����
����Ŀ����ͼ��ʾ�����Թܷ���ʢ��25��ı���ʯ��ˮ���ձ��У��Թ��п�ʼ���뼸С��þƬ�����õιܵ���5mL�������Թ��У��Իش����лش� 
��1��ʵ���й۲쵽�������� ��
A.�Թ���þƬ���ܽ�
B.�Թ��в�����ɫ����
C.�ձ���ڱ���
D.�ձ��ײ�����������ɫ����
��2���Թ��з����ķ�Ӧ������ѡ�������ԭ��Ӧ����������ԭ��Ӧ������
��3��д���йط�Ӧ�����ӷ���ʽ ��
��4����ʵ����֪��MgCl2��Һ��H2��������������ڡ���С�ڡ������ڡ���þƬ���������������
���𰸡�
��1��ABD
��2��������ԭ��Ӧ
��3��Mg+2H+=Mg2++H2��
��4����
���������⣺��1��Mgλ����֮ǰ���ܺ�ϡ���ᷴӦ�����������÷�Ӧ�Ƿ��ȷ�Ӧ���ų�������ʹ�ձ�����Һ�¶����ߣ����������ܽ�������¶����߶���С��A��þ��ϡ���ᷴӦ�����Ȼ�þ�������������Թ���þƬ���ܽ⣬����ȷ��B�����������������Թ��в�����ɫ���ݣ�����ȷ��C����������ķ�Ӧ�Ƿ��ȷ�Ӧ�������ձ���ڱ��ȣ��ʴ���D�����������ܽ�������¶����߶���С�������¶ȣ��������Ʊ�����Һ��Ϊ��������Һ�������ձ��ײ�����������ɫ���壬����ȷ����ѡABD����2�����������ӷ�ӦΪMg+2H+=Mg2++H2�����÷�Ӧ���е���ת�ƣ���������������ԭ��Ӧ���ʴ�Ϊ��������ԭ��Ӧ����3�����ʡ����塢������д��ѧʽ��������ǿ�����д���ӣ����ӷ���ʽΪMg+2H+=Mg2++H2�����ʴ�ΪMg+2H+=Mg2++H2������4�����ȷ�Ӧ�з�Ӧ���������������������������÷�Ӧ�Ƿ��ȷ�Ӧ������MgCl2��Һ��H2��������С��þƬ����������������ʴ�Ϊ��С�ڣ�
��1��Mgλ����֮ǰ���ܺ�ϡ���ᷴӦ�����������÷�Ӧ�Ƿ��ȷ�Ӧ���ų�������ʹ�ձ�����Һ�¶����ߣ����������ܽ�������¶����߶���С����2���е���ת�ƵĻ�ѧ��Ӧ��������ԭ��Ӧ����3�����ʡ����塢������д��ѧʽ��������ǿ�����д���ӣ���4�����ȷ�Ӧ�з�Ӧ��������������������������

 �Ķ��쳵ϵ�д�
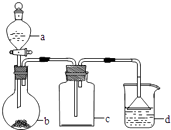
�Ķ��쳵ϵ�д�����Ŀ��ʵ������ijЩ�������ȡ���ռ���β������װ����ͼ��ʾ��ʡ�Լгֺ;���װ�ã������ô�װ�úͱ����ṩ������������ʵ�飬�������ѡ���ǣ� ��
ѡ�� | a�е����� | b�е����� | c���ռ������� | d�е����� |
A | Ũ��ˮ | CaO | NH3 | H2O |
B | Ũ���� | Na2SO3 | SO2 | NaOH��Һ |
C | ϡ���� | Cu | NO2 | H2O |
D | Ũ���� | MnO2 | Cl2 | NaOH��Һ |
A.A
B.B
C.C
D.D