题目内容
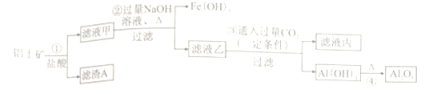
【题目】用金属钴板(含少量Fe、Ni)制备应用广泛的氯化钴的工艺流程如下:
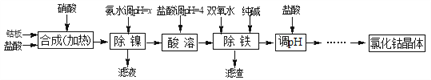
注:钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产。
有关钴、镍和铁化合物的性质见下表:
化学式 | 沉淀完全时的pH | 钴镍性质 |
Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3·H2O=Co(OH)2↓+2NH4+ Co2++2H2O Ni+2HCl=NiCl2+H2↑ Ni2++6NH3·H2O=[Ni(NH3)6]2++6H2O |
Fe(OH)2 | 9.6 | |
Fe (OH)3 | 3.7 |
(1)“除镍”步骤中,NH3·H2O用量对反应收率的影响见表中数据:从表中数据可知,当PH调节至x=_______时,除镍效果最好。
加NH3·H2O调pH | 收率/% | Ni2+含量/% |
9 | 98.1 | 0.08 |
9.5 | 98 | 0.05 |
10 | 97.6 | 0.005 |
10.3 | 94 | 0.005 |
(2)“除镍”步骤必须控制在一定的时间内完成,否则沉淀中将有部分Co(OH)2转化为Co(OH)3,此反应的化学方程式为________________。
(3)“除铁”步骤中加入双氧水发生反应的离子方程式是________________________。
(4)“除铁”步骤中加入的纯碱作用是_______________________________。
(5)在“调pH”步骤中,加盐酸的作用是______________________________。
(6)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O![]() Fe(OH)3+3H+的平衡常数为_____________________。
Fe(OH)3+3H+的平衡常数为_____________________。
【答案】 10 4Co(OH)2+O2+2H2O=4Co(OH)3 (没有配平扣1分) 2Fe2++H2O2+2H+=2Fe3++2H2O (没有配平扣1分) 使Fe3+转化为Fe(OH)3沉淀而除去(或2Fe3++3CO32-+6H2O=2Fe(OH)3↓+3CO2↑) 防止Co2+水解 2.5×10-5 (mol·L-1)2(没有单位不扣分)
【解析】用金属钴板(含少量Fe、Ni)制备应用广泛的氯化钴的工艺流程为:钴板在稀硝酸作催化剂条件下反应生成氯化镍、氯化钴和氯化铁、氯化亚铁等,调节溶液的pH除去镍,然后加入双氧水将亚铁离子氧化成铁离子,然后加入纯碱将铁离子转化成氢氧化铁除去,最后经过一系列操作得到氯化钴晶体。
(1)根据表中的数据知道,当pH等于10的时,收率最高,镍离子的含量最小,除镍效果最好,故答案为:10;
(2)钴离子易从正二价容易被氧气氧化到正三价,发生的化学方程式为:4Co(OH)2+O2+2H2O=4Co(OH)3,故答案为:4Co(OH)2+O2+2H2O=4Co(OH)3;
(3)双氧水具有氧化性,可以将亚铁离子氧化为正三价,发生的化学反应为:2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)加入碳酸钠可以和酸发生反应,在适当的环境下,可以让铁离子形成沉淀而除去,所以加入的纯碱作用是起到调节溶液的pH的作用,故答案为:使铁离子转化为氢氧化铁沉淀而除去(或2Fe3++3CO32-+6H2O=2Fe(OH)3↓+3CO2↑);
(5)钴离子是弱碱阳离子,能发生水解,显示酸性,加入盐酸可以防止Co2+水解,故答案为:防止Co2+水解;
(6)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38,c(H+)=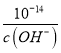 ,反应Fe3++3H2OFe(OH)3+3H+的平衡常数K=
,反应Fe3++3H2OFe(OH)3+3H+的平衡常数K=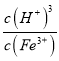 =
=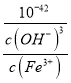 =
=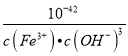 =
=![]() =2.5×10-5,故答案为:2.5×10-5。
=2.5×10-5,故答案为:2.5×10-5。