题目内容
【题目】在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为____________, 含有离子键、____________等化学键。
(2)生成物中含有10个电子的分子是________(写分子式),该分子的空间构型_______,中心原子的杂化方式为___________________。
(3)反应物中电负性最大的元素为________(填元素符号),写出其原子最外层的电子排布图:_______________。
(4)冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是__________(填微粒符号)。
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___________个; Al晶体的密度为________(用字母表示)。
【答案】 Na3AlF6 共价键、配位键 H2O V形 sp3 F ![]() Na+ 4
Na+ 4 ![]()
【解析】(1)冰晶石的成分是Na3AlF6,该物质中Na+和AlF6-之间存在离子键,Al原子和F原子之间存在配位键和共价键,故答案为:Na3AlF6;共价键和配位键;
(2)H2O中含有10个电子,水分子中含有2个共价单键和2个孤电子对,所以其空间构型为V形,O原子采用杂化,故答案为:H2O;V形;sp3;
(3)元素的非金属性越强,其电负性越强,所以电负性最强的是F元素;F原子核外最外层上s、p能级,s、p能级上电子分别是2、5,其最外层轨道表示式为![]() ,故答案为:F;
,故答案为:F;![]() ;
;
(4)●的个数=8×![]() +6×
+6×![]() =4,○个数=12×
=4,○个数=12×![]() +8+1=12,要使两种离子的个数之比为1:3,则大立方体的体心处所代表的微粒是Na+,故答案为:Na+;
+8+1=12,要使两种离子的个数之比为1:3,则大立方体的体心处所代表的微粒是Na+,故答案为:Na+;
(5)该晶胞中Al原子个数=8×![]() +6×
+6×![]() =4,该晶胞棱长=
=4,该晶胞棱长=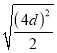 =2
=2![]() d,所以晶胞的体积=(2
d,所以晶胞的体积=(2![]() d)3,ρ=
d)3,ρ=![]() =
= =
=![]() ,故答案为:4;
,故答案为:4; ![]() 。
。

【题目】用金属钴板(含少量Fe、Ni)制备应用广泛的氯化钴的工艺流程如下:
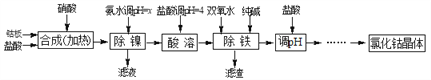
注:钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产。
有关钴、镍和铁化合物的性质见下表:
化学式 | 沉淀完全时的pH | 钴镍性质 |
Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3·H2O=Co(OH)2↓+2NH4+ Co2++2H2O Ni+2HCl=NiCl2+H2↑ Ni2++6NH3·H2O=[Ni(NH3)6]2++6H2O |
Fe(OH)2 | 9.6 | |
Fe (OH)3 | 3.7 |
(1)“除镍”步骤中,NH3·H2O用量对反应收率的影响见表中数据:从表中数据可知,当PH调节至x=_______时,除镍效果最好。
加NH3·H2O调pH | 收率/% | Ni2+含量/% |
9 | 98.1 | 0.08 |
9.5 | 98 | 0.05 |
10 | 97.6 | 0.005 |
10.3 | 94 | 0.005 |
(2)“除镍”步骤必须控制在一定的时间内完成,否则沉淀中将有部分Co(OH)2转化为Co(OH)3,此反应的化学方程式为________________。
(3)“除铁”步骤中加入双氧水发生反应的离子方程式是________________________。
(4)“除铁”步骤中加入的纯碱作用是_______________________________。
(5)在“调pH”步骤中,加盐酸的作用是______________________________。
(6)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O![]() Fe(OH)3+3H+的平衡常数为_____________________。
Fe(OH)3+3H+的平衡常数为_____________________。