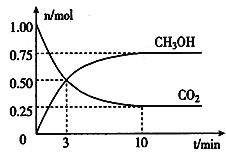
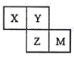
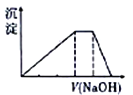
题目内容
【题目】中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期。Y和M位于同主族,Y原子最外层电子数是电子层数的3倍。这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生的沉定与氢氧化钠溶液体积的关系如图所示。下列说法不正确的是
A. 气态氢化物的沸点:Y>X
B. R与除Z以外的其他3种元素均能形成共价化合物
C. 简单离子的半径:M>Y>Z
D. Y与其他4种元素均可形成至少两种二元化合物
【答案】D
【解析】根据题意判断R、X、Y、Z、M分别是氢、氮、氧、铝、硫。Q是NH4Al(SO4)2。A. 常温下水是液体,氨是气体,所以气态氢化物的沸点:Y>X,故A正确;B. R与除Z以外的其他3种元素均能形成共价化合物氢化物,故B正确;C. 电子层结构相同离子的半径随着核电荷数增大而减小,所以离子半径:Y>Z,同主族元素离子半径随着电子层数增大而增大,所以离子半径:M>Y,总之,简单离子的半径:M>Y>Z,故C正确;D. 氧与铝只能形成氧化铝,故D不正确。故选D。

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】用金属钴板(含少量Fe、Ni)制备应用广泛的氯化钴的工艺流程如下:
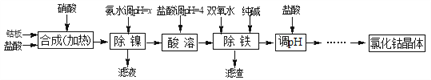
注:钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产。
有关钴、镍和铁化合物的性质见下表:
化学式 | 沉淀完全时的pH | 钴镍性质 |
Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3·H2O=Co(OH)2↓+2NH4+ Co2++2H2O Ni+2HCl=NiCl2+H2↑ Ni2++6NH3·H2O=[Ni(NH3)6]2++6H2O |
Fe(OH)2 | 9.6 | |
Fe (OH)3 | 3.7 |
(1)“除镍”步骤中,NH3·H2O用量对反应收率的影响见表中数据:从表中数据可知,当PH调节至x=_______时,除镍效果最好。
加NH3·H2O调pH | 收率/% | Ni2+含量/% |
9 | 98.1 | 0.08 |
9.5 | 98 | 0.05 |
10 | 97.6 | 0.005 |
10.3 | 94 | 0.005 |
(2)“除镍”步骤必须控制在一定的时间内完成,否则沉淀中将有部分Co(OH)2转化为Co(OH)3,此反应的化学方程式为________________。
(3)“除铁”步骤中加入双氧水发生反应的离子方程式是________________________。
(4)“除铁”步骤中加入的纯碱作用是_______________________________。
(5)在“调pH”步骤中,加盐酸的作用是______________________________。
(6)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O![]() Fe(OH)3+3H+的平衡常数为_____________________。
Fe(OH)3+3H+的平衡常数为_____________________。