题目内容
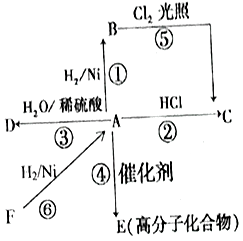
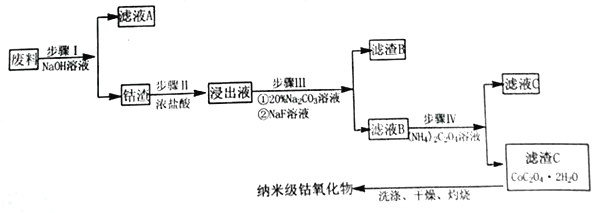
【题目】纳米氧化钴在半导体和微电子行业应用广泛,某些金属废料中含有Co元素,从废料(含Co3O4、Al2O3、Li2O、Fe2O3等物质) 中制备高纯度的纳米级钴的氧化物,流程如下
已知:
①LiF 难溶于水,Li2CO3微溶于水;
②钴元素常见的化合价为+2 和+3;
③部分金属离子形成氢氧化物沉淀的pH见下表。
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中发生的离子反应方程式_______________;
(2)步骤II加浓盐酸的作用是_______________;
(3)步骤III中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH的取值范围为_______________; 滤渣 B 的主要成分为_________________;
(4)简述如何检验滤液B中是否还有残留的Fe3+:_______________;
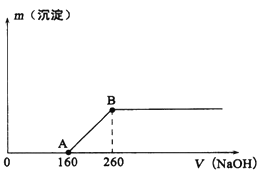
(5) 经过反复洗涤、干燥后称重,将质量为3.66gCoC2O4·2H2O进行灼烧,残留固体质量如图所示。
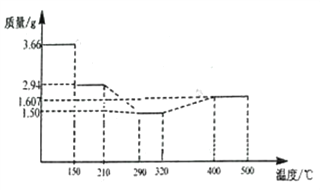
210℃~290℃时若生成两种气体,则发生反应的化学方程式为_______________,400℃~500℃所得固体的化学式为_______________;
【答案】 Al2O3+ 2OH-= 2AlO2-+ H2O 溶解Li2O、Fe2O3、并将Co3O4转化为Co2+,防止在后续除杂中将Co3+沉淀而造成损失 3.2≤pH<7.15 LiF、Fe(OH)3 取少量滤液B于试管中,向其中滴加KSCN溶液,观察溶液是否变红,若变红,则有Fe3+,反之则无Fe3+ CoC2O4![]() CoO+CO↑+CO2↑ Co3O4
CoO+CO↑+CO2↑ Co3O4
【解析】试题分析:本题以含Co3O4、Al2O3、Li2O、Fe2O3等物质的废料制备高纯度的纳米级钴的氧化物的流程为载体,考查流程的分析,方程式的书写,条件的控制,Fe3+的检验,热重图像的计算。步骤I向废料中加入NaOH溶液,废料中的Al2O3溶解得到滤液A,钴渣中主要成分为Co3O4、Li2O、Fe2O3等;由滤渣C逆推出滤液B中含Co2+,结合表中金属离子形成沉淀的pH,步骤II向钴渣中加入浓盐酸,Co3O4转化成CoCl2,Li2O转化成LiCl,Fe2O3转化成FeCl3;根据图示和已知①、③,步骤III中加入20%Na2CO3溶液的作用是除去Fe3+,加入NaF溶液的作用是除去Li+。
(1)步骤I中加入NaOH溶液,Al2O3与NaOH反应生成NaAlO2和H2O,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O。
(2)步骤II中加入浓盐酸发生反应:Co3O4+8HCl(浓)=3CoCl2+Cl2↑+4H2O、Li2O+2HCl=2LiCl+H2O、Fe2O3+6HCl=2FeCl3+3H2O,加入浓盐酸的作用是:溶解Li2O、Fe2O3、并将Co3O4转化为Co2+,防止在后续除杂中将Co3+沉淀而造成损失。
(3)步骤III中加入20%Na2CO3溶液的作用是除去Fe3+,根据金属离子形成氢氧化物沉淀的pH,pH的取值范围为3.2![]() pH
pH![]() 7.15(使Fe3+完全沉淀,Co2+不形成沉淀)。加入NaF使浸出液中的Li+转化为LiF沉淀,滤渣B的主要成分为LiF、Fe(OH)3。
7.15(使Fe3+完全沉淀,Co2+不形成沉淀)。加入NaF使浸出液中的Li+转化为LiF沉淀,滤渣B的主要成分为LiF、Fe(OH)3。
(4)检验Fe3+用KSCN溶液,检验滤液B中是否还有残留的Fe3+的方法:取少量滤液B于试管中,向其中滴加KSCN溶液,观察溶液是否变红,若变红,则有Fe3+,反之则无Fe3+。
(5)n(CoC2O4·2H2O)=3.66g![]() 183g/mol=0.02mol,其中n(CoC2O4)=0.02mol,m(Co2C2O4)=0.02mol
183g/mol=0.02mol,其中n(CoC2O4)=0.02mol,m(Co2C2O4)=0.02mol![]() 147g/mol=2.94g。150℃~210℃固体质量为2.94g,此时固体为CoC2O4;290℃~320℃时固体质量为1.50g,根据Co守恒,其中n(Co)=0.02mol,n(O)=(1.50g-0.02mol
147g/mol=2.94g。150℃~210℃固体质量为2.94g,此时固体为CoC2O4;290℃~320℃时固体质量为1.50g,根据Co守恒,其中n(Co)=0.02mol,n(O)=(1.50g-0.02mol![]() 59g/mol)
59g/mol)![]() 16g/mol=0.02mol,n(Co):n(O)=0.02mol:0.02mol =1:1,290℃~320℃时固体为CoO,210℃~290℃时反应生成两种气体,则反应的方程式为CoC2O4
16g/mol=0.02mol,n(Co):n(O)=0.02mol:0.02mol =1:1,290℃~320℃时固体为CoO,210℃~290℃时反应生成两种气体,则反应的方程式为CoC2O4![]() CoO+CO↑+CO2↑。400℃~500℃时固体中n(Co)=0.02mol,固体中n(O)=(1.607g-0.02mol
CoO+CO↑+CO2↑。400℃~500℃时固体中n(Co)=0.02mol,固体中n(O)=(1.607g-0.02mol![]() 59g/mol)
59g/mol)![]() 16g/mol=0.0267mol,n(Co):n(O)=0.02mol:0.0267mol=3:4,400℃~500℃所得固体的化学式为Co3O4。
16g/mol=0.0267mol,n(Co):n(O)=0.02mol:0.0267mol=3:4,400℃~500℃所得固体的化学式为Co3O4。

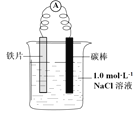
【题目】某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:
装置 | 分别进行的操作 | 现象 |
| i. 连好装置一段时间后,向烧杯中滴加酚酞 | |
ii. 连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液 | 铁片表面产生蓝色沉淀 |
(1)小组同学认为以上两种检验方法,均能证明铁发生了吸氧腐蚀。
①实验i中的现象是________________________________。
②用化学用语解释实验i中的现象:________________________________。
(2)查阅资料:K3[Fe(CN)6]具有氧化性。
①据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是_____________________。
②进行下列实验,在实验几分钟后的记录如下:
实验 | 滴管 | 试管 | 现象 |
| 0.5 mol·L-1K3[Fe(CN)6]溶液 | iii. 蒸馏水 | 无明显变化 |
iv. 1.0 mol·L-1NaCl溶液 | 铁片表面产生大量蓝色沉淀 | ||
v. 0.5 mol·L-1 Na2SO4溶液 | 无明显变化 |
a. 以上实验表明:在条件下____________,K3[Fe(CN)6]溶液可以与铁片发生反应。
b. 为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明Cl-的作用是____________________。
(3)有同学认为上述实验仍不严谨。为进一步探究K3[Fe(CN)6]的氧化性对实验ii结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是___________(填字母序号)。
实验 | 试剂 | 现象 |
A | 酸洗后的铁片、K3[Fe(CN)6]溶液(已除O2) | 产生蓝色沉淀 |
B | 酸洗后的铁片、K3[Fe(CN)6]和NaCl混合溶液(未除O2) | 产生蓝色沉淀 |
C | 铁片、K3[Fe(CN)6]和NaCl混合溶液(已除O2) | 产生蓝色沉淀 |
D | 铁片、K3[Fe(CN)6]和盐酸混合溶液(已除O2) | 产生蓝色沉淀 |
(4)综合以上实验分析,利用实验ii中试剂能证实铁发生了电化学腐蚀的实验方案是____________________________。