题目内容
7.含硫化合物的种类很多,现有SO2、Na2SO3、H2SO4、CuSO4 四种常见的含硫化合物.回答下列问题:
(1)将SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色.反应结束后,硫元素存在形式合理的是D.
A.S2- B.S C.SO32- D.SO42-
(2)亚硫酸钠中的硫呈+4价,它既有氧化性又有还原性,现有试剂:溴水、H2S、稀硫酸.请选取合适的试剂证明Na2SO3具有还原性.
所选试剂是溴水,该反应的离子方程式为:SO32-+Br2+H2O=2H++SO42-+2Br-.
(3)常温下,将铁棒置于浓硫酸中,无明显现象,有人认为未发生反应.为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面无明显现象,则发生了钝化;若铁棒表面有紫红色物质析出,则未发生反应.
(4)用铜制备CuSO4溶液,可设计以下三种途径:

写出途径①中反应的离子方程式3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,最佳途径是②(填序号),理由是原料利用率高,环境污染小.
分析 (1)将SO2通入酸性KMnO4溶液中,被氧化,S元素化合价升高;
(2)证明Na2SO3具有还原性,则选氧化剂,如溴水;
(3)钝化是在金属表面生成一层致密的氧化物保护膜,阻止内部进行进行反应,若发生钝化,则氧化铁保护膜阻止Fe与硫酸铜反应,否则发生反应,会有铜析出;
(4)途径①是铜和稀硫酸和稀硝酸混酸反应,硝酸全部做氧化剂反应生成一氧化氮,浓硫酸和铜加热反应生成二氧化硫污染环境,铜和氧气反应生成氧化铜与稀硫酸反应过程中无污染性气体,原料利用率高;
解答 解:(1)将SO2通入酸性KMnO4溶液中,被氧化,S元素化合价升高,被氧化生成SO42-,故答案为:D;
(2)要证明Na2SO3具有还原性,应选用具有氧化性的试剂,在所给的试剂中溴水具有较强的氧化性,且溴水有颜色,反应现象明显,若Na2SO3具有还原性,则会使溴水的橙色褪去,反应为:Na2SO3+Br2+H2O=H2SO4+2NaBr,
故答案为:溴水,SO32-+Br2+H2O=2H++SO42-+2Br-;
(3)钝化是在金属表面生成一层致密的氧化物保护膜,阻止内部进行进行反应,若发生钝化,则氧化铁保护膜阻止Fe与硫酸铜反应,无明显现象,否则发生反应,会有紫红色的铜析出,
故答案为:无明显现象;有紫红色物质析出;
(4)途径①是铜和稀硫酸和稀硝酸混酸反应,硝酸全部做氧化剂反应生成一氧化氮,反应的离子方程式为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,浓硫酸和铜加热反应生成二氧化硫污染环境,铜和氧气反应生成氧化铜与稀硫酸反应过程中无污染性气体,原料利用率高,所以方案②是最佳途径,
故答案为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,②,原料利用率高,环境污染小;
点评 本题考查了含硫物质性质的分析判断,主要是氧化还原反应产物分析,硫酸铜制备途径的分析判断,掌握基础是关键,题目难度中等.

| A. | 食盐水 | B. | 烧碱溶液 | C. | 纯碱溶液 | D. | 稀醋酸 |
| A. | 水中加入钠:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 碳酸氢钙溶液加入盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 氢氧化铜中加入盐酸:OH-+H+═H2O | |
| D. | 碳酸镁跟稀硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
| A. | N2、NO2、粉尘、煤烟 | B. | CO2、O2、氮的氧化物、碳氢化合物 | ||
| C. | Cl2、N2、煤烟、氮的氧化物 | D. | H2S、SO2、粉尘、煤烟、氮的氧化物 |
| A. | FeBr2溶液中滴入过量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| B. | 酸性条件下,FeSO4溶液与H2O2反应:Fe2++2H++H2O2=Fe3++2H2O | |
| C. | SO2通入Ca(ClO)2溶液中:Ca(ClO)2+SO2+H2O=CaSO3↓+2HClO | |
| D. | NaAlO2溶液与NaHCO3溶液混合:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32- |
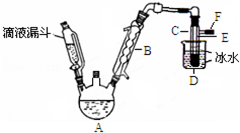 如图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置.有关数据见表:
如图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置.有关数据见表:表.乙醇、溴乙烷、溴有关参数
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.减少HBr的挥发 d.水是反应的催化剂
(2)已知加热温度较低时NaBr与硫酸反应生成NaHSO4,写出加热时A中发生的主要反应的化学方程式CH3CH2OH+NaBr+H2SO4$\stackrel{△}{→}$NaHSO4+CH3CH2Br+H2O.
(3)仪器B的名称球形冷凝管,冷却水应从B的下(填“上”或“下”)口流进.
(4)反应生成的溴乙烷应在C中(填“A”或“C”中).
(5)若用浓的硫酸进行实验时,得到的溴乙烷呈棕黄色,最好选择下列b(选填序号)溶液来洗涤产品.
a.氢氧化钠 b.亚硫酸钠 c.碘化亚铁 d.碳酸氢钠
洗涤产品时所需要的玻璃仪器有分液漏斗、烧杯.
| A. | CH3-CH━CH一CH3 | B. | CH3-C≡CH | C. | CH≡CH | D. | CH3-C≡C-CH |
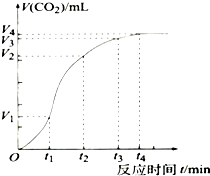 为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线(图).请分析讨论以下问题.
为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线(图).请分析讨论以下问题.