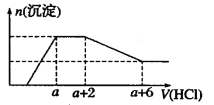
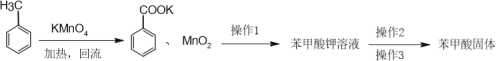
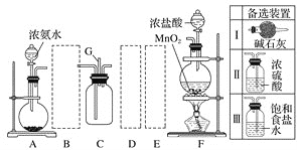
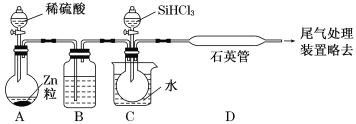
题目内容
【题目】“温室效应”是哥本哈根世界气候变化大会研究的环境问题之一。CO2气体在大气层中具有吸热和隔热的功能,是主要的温室气体。
(1)下列措施中,有利于降低大气中CO2浓度的是__________(填字母编号)。
A 采用节能技术,减少化石燃料的用量
B 鼓励乘坐公交车出行,倡导“低碳”生活
C 利用太阳能、风能等新型能源替代化石燃料
(2)CH4是另一种主要的温室气体,lg甲烷完全燃烧生成液态水和二氧化碳,放出55.64kJ的热量,写出表示甲烷燃烧的热化学方程式_______________。
(3)酸雨的形成主要是由废气中的SOx和NOx造成的,某空气污染监测仪是根据SO2与Br2、H2O的定量反应来测定空气中SO2含量的,该反应的化学方程式为:____________。
(4)某硫酸工厂以黄铁矿为原料生产硫酸。第一阶段燃烧黄铁矿的化学方程式为4FeS2+11O2![]() 2Fe2O3+8SO2:第二阶段的反应原理是2SO2(g)+O2(g)
2Fe2O3+8SO2:第二阶段的反应原理是2SO2(g)+O2(g)![]() 2SO3(g),其生产设备的名称为接触室;在生产过程中某一时刻取样SO2、O2、SO3的浓度分别为2mol·L-1、2mol·L-1、3mol·L-1,当反应达到平衡时,可能存在的数据是__________(填字母编号)
2SO3(g),其生产设备的名称为接触室;在生产过程中某一时刻取样SO2、O2、SO3的浓度分别为2mol·L-1、2mol·L-1、3mol·L-1,当反应达到平衡时,可能存在的数据是__________(填字母编号)
A SO2为5mol·L-1,O2为3.5mol·L-1
B SO2为3mol·L-1
C SO2、SO3均为2.5mol·L-1
D SO3为5mol·L-1
【答案】ABC CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH =-890.24kJ·mol-1 SO2+Br2+2H2O=2HBr+H2SO4 BC
【解析】
(1)A、节能技术能减少化石燃料的使用;
B、减少化石燃料的消耗,倡导节能减排生活;
C、利用太阳能、风能可以减少化石燃料的使用;
(2)、依据热化学方程式的书写方法进行解答,注意标注物质聚集状态和对应焓变;
(3)、SO2和Br2、H2O的定量反应生成硫酸和溴化氢;
(4)、化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,由于硫元素守恒,c (SO3) +c (SO2)之和不变,据此判断分析。
(1)A、采用节能技术能减少化石燃料的使用,减少化石燃料的使用就减少了二氧化碳的排放,所以正确;
B、化石燃料燃烧产物是二氧化碳,减少化石燃料的使用就减少了二氧化碳的排放,所以正确;
C、利用太阳能、风能能减少化石燃料的使用,化石燃料燃烧产物是二氧化碳,减少化石燃料的使用就减少了二氧化碳的排放,所以正确;
故选:ABC;
(2)、1g甲烷生成液态水和二氧化碳气体,放出55.64kJ的热量,16g甲烷燃烧放热890.24kJ,热化学方程式为:CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH =-890.24kJ·mol-1;
故答案为:CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH =-890.24kJ·mol-1;
(3)、SO2和Br2、H2O的定量反应生成硫酸和溴化氢,方程式为:SO2+Br2+2H2O=2HBr+H2SO4;
故答案为:SO2+Br2+2H2O=2HBr+H2SO4
(4)、2SO2(g)+ O2(g) ==2SO3(g)
某时刻 2mol/L 2mol/ L 3mol/L
极限转化5mol/ L 3.5mol/ L 0mol/L
极限转化0mol/L 1mol/L 5mol/L.
A、由于反应为可逆反应,SO2的浓度一定小于5mol/L,O2一定小于3.5mol/L,故A错误;
B、根据以上分析,SO2的浓度在0到5mol/L之间,故B正确;
C、根据元素守恒定律,c(SO2) + c(SO3)= 5mol/L,则SO2、SO3均为2.5mol./L,故C正确;
D、由于反应为可逆反应,SO3的浓度一定小于5mol/L,故D错误;
故选:BC。

 智慧小复习系列答案
智慧小复习系列答案【题目】观察下列模型并结合有关信息,判断下列说法不正确的是( )
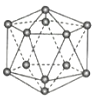
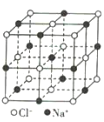
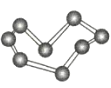
晶体硼(其每个结构单元中有12个B原子) | NaCl | S8 | HCN | |
结构模型示意图 |
|
|
|
|
备注 | 熔点2573K | —— | 易溶于CS2 | —— |
A.晶体硼属于原子晶体,结构单元中含有30个B-B键,含20个正三角形
B.NaCl晶体中每个Na+周围距离最近且相等的Na+有6个
C.S8分子中的共价键为非极性键
D.HCN分子中含有2个σ键,2个π键