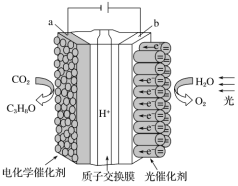
题目内容
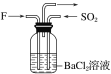
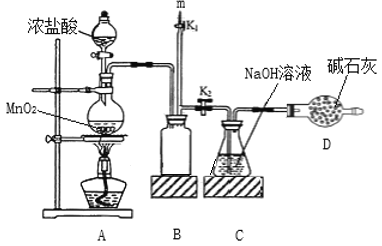
【题目】某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。

请回答下列问题:
(1)装置A中的烧瓶内固体可选用__(填字母)。
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(2)虚线框内应添加必要的除杂装置,请从表格中的备选装置中选择,并将编号填入下列空格:B__,D__,E__。
(3)通入C装置的两根导管左边较长、右边较短,目的是__。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:__;其中氧化剂与还原剂的物质的量之比为__;当amol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗常数为__mol-1(用含a、b的代数式表示)。
(5)从装置C的出气管口G处逸出的尾气可能含有污染环境的气体,如何处理?_。
【答案】ABE Ⅰ Ⅱ Ⅲ 使密度较大的Cl2和密度较小的NH3较快地混合均匀 3Cl2+8NH3=N2+6NH4Cl 3:2 ![]() 在G后连接导管,直接把尾气通入盛有NaOH溶液的烧杯中
在G后连接导管,直接把尾气通入盛有NaOH溶液的烧杯中
【解析】
探究氯气和氨气的反应,则首先要制得氨气和氯气,装置A用于制取氨气,制得的氨气中含有水蒸气,需要除去,干燥氨气选用碱石灰,装置F制取氯气,氯气中含有HCl和H2O,需要除去和干燥,利用饱和食盐水除去HCl,利用浓硫酸除去H2O。在C中发生氨气与氯气的反应。
(1)装置A用于制取氨气,碱石灰、生石灰、烧碱遇水都会放热,使氨水温度升高,导致氨气逸出,可以选ABE;
(2)氨气是碱性气体,要用碱性干燥剂碱石灰干燥;由于浓盐酸有挥发性,所以制取的Cl2含有杂质HCl,应该先用饱和NaCl溶液除去其中的HCl,再用浓硫酸干燥,所以B选Ⅰ装置,D选Ⅱ装置,E选Ⅲ装置,经过除杂干燥后在装置C中发生反应;
(3)氨气的密度比Cl2的密度小,通入C装置的两根导管左边较长、右边较短,就可以使密度较大的Cl2和密度较小的NH3较快地混合均匀;
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。则白色固体是NH4Cl,另一生成物是N2,根据得失电子守恒、原子守恒可得该反应的化学方程式是3Cl2+8NH3=N2+6NH4Cl;在该反应中氧化剂是Cl2,还原剂是NH3,每有3molCl2发生反应,消耗8molNH3,其中有2molNH3做还原剂。故氧化剂与还原剂的物质的量之比为3:2;当amol氯气参加反应时,转移的电子为2amol,转移电子的个数为b,所以阿伏加德罗常数为NA=![]() mol-1;
mol-1;
(5)从装置C的出气管口G处逸出的尾气可能含有Cl2、NH3,Cl2能够与NaOH溶液发生反应,NH3易溶于NaOH溶液,则应该将尾气通入到盛有NaOH溶液的烧杯中。

 名校课堂系列答案
名校课堂系列答案【题目】苯甲酸甲酯是重要的化工原料,某化学兴趣小组仿照实验室制乙酸乙酯的原理以苯甲酸和甲醇为原料制备苯甲酸甲酯。有关数据如下:
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/(gcm-3) | 水溶性 | |
苯甲酸 | 122 | 122.4 | 249 | 1.2659 | 微溶 |
甲醇 | 32 | -97 | 64.6 | 0.792 | 互溶 |
苯甲酸甲酯 | 136 | -12.3 | 196.6 | 1.0888 | 不溶 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇,再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,在圆底烧瓶上连接冷凝回流装置后,小心加热2小时,得苯甲酸甲酯粗产品。回答下列问题:
(1)该反应的化学方程式为_____。
(2)实验中,应选择_____(填序号)作为冷凝回流装置,该仪器的名称为_____。

(3)使用过量甲醇的原因是_____。
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制。

(4)饱和碳酸钠溶液的作用是_____,操作b的名称为_____。
(5)该实验中制得苯甲酸甲酯8.5g,则苯甲酸甲酯的产率为_____。