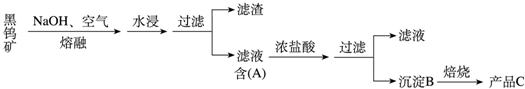
题目内容
5.如图所示的转化关系中,每个字母均代表中学化学常见的物质,各字母前的数字代表参加反应或生成该物质的物质的量,部分反应条件及产物已略去,其中1molA、2molB及1molZ的质量均相等.在同周期简单离子中W的离子半径最小,A和D的焰色反应均呈黄色.请回答下列问题:
(1)W离子的符号为Al3+,C的电子式为
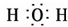 ,B的原子结构示意图为
,B的原子结构示意图为 .
.(2)B与C反应的化学方程式为2K+2H2O=2KOH+H2↑.
(3)图中涉及的物质中,属于共价化合物的是H2O(填化学式).
(4)图中的转化关系中,x=$\frac{4}{3}$.

分析 因为A.D的焰色反应呈黄色,说明A.D均含有钠元素,又在同周期简单离子中W的离子半径最小,同周期阴阳离子半径都递减,但阴离子半径都比阳离子大,所以可知W为铝离子,对应的生成物Z为氢氧化铝或者偏铝酸盐;根据1molA,2molB,2molZ的质量相同,所以可知Z为氢氧化铝,A为过氧化钠,B为钾.C为水,D为氢氧化钠,E为氧气,F为氢气,G为氢氧化钾,据此分析.
解答 解:因为A.D的焰色反应呈黄色,说明A.D均含有钠元素,又在同周期简单离子中W的离子半径最小,同周期阴阳离子半径都递减,但阴离子半径都比阳离子大,所以可知W为铝离子,对应的生成物Z为氢氧化铝或者偏铝酸盐;根据1molA,2molB,2molZ的质量相同,所以可知Z为氢氧化铝,A为过氧化钠,B为钾.C为水,D为氢氧化钠,E为氧气,F为氢气,G为氢氧化钾,
(1)根据以上分析,W离子的符号为Al3+,C为水,电子式为: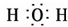 ,B为钾,原子结构示意图为
,B为钾,原子结构示意图为 ,故答案为:Al3+;
,故答案为:Al3+;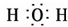 ;
; ;
;
(2)B为钾.C为水,B与C反应的化学方程式为2K+2H2O=2KOH+H2↑,故答案为:2K+2H2O=2KOH+H2↑;
(3)根据以上分析,则图中涉及的物质A为过氧化钠,B为钾.C为水,D为氢氧化钠,E为氧气,F为氢气,G为氢氧化钾,属于共价化合物的是H2O,故答案为:H2O;
(4)根据以上分析,则图中涉及的物质D为氢氧化钠,G为氢氧化钾,W为铝离子,发生Al3++3OH-=Al(OH)3↓,又2D+2G+xAl3+=1Al(OH)3↓,所以x=$\frac{4}{3}$,故答案为:$\frac{4}{3}$.
点评 本题考查了物质转化关系的判断,物质性质的应用,反应现象的应用,主要考查钠、铝及其化合物性质,综合性较强.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.将下列四种铁的化合物溶于稀盐酸,滴加KSCN溶液没有颜色变化,再加入氯水即可显血红色的是( )
| A. | FeO | B. | Fe2O3 | C. | FeCl3 | D. | Fe(OH)3 |
16.乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味.实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
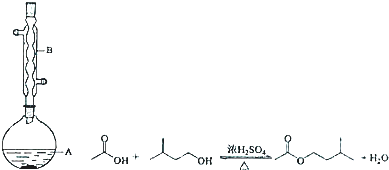
某同学的实验步骤:
①在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸;
②缓慢加热A,回流50min;
③反应液冷至室温后倒入仪器甲中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;
④分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体;
⑤进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯2.6g.
请回答下列问题:
(1)该酯化反应的原子利用率是$\frac{23}{26}$(用分数表示).
(2)实验中仪器B的作用是冷凝回流,步骤③中的仪器甲是分液漏斗.
(3)该同学开始加热A后,发现此前操作中有一处严重的疏漏,如何补救?装置冷却后再补加数片沸石或碎瓷片.
(4)步骤④中加入无水MgSO4是为了除去某种杂质,如何检验该杂质是否除尽?简述实验方法:取出部分产物,往其中中加入少量无水硫酸铜,若不变蓝,表明水已除尽.
(5)步骤⑤中,若温度计水银球的位置过高,则所收集馏分的沸点高于(填“高于”或“低于”)目标产物的沸点.
(6)本实验的产率是d(填标号). a.30% b.40% c.50% d.60%

| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戍醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
①在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸;
②缓慢加热A,回流50min;
③反应液冷至室温后倒入仪器甲中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;
④分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体;
⑤进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯2.6g.
请回答下列问题:
(1)该酯化反应的原子利用率是$\frac{23}{26}$(用分数表示).
(2)实验中仪器B的作用是冷凝回流,步骤③中的仪器甲是分液漏斗.
(3)该同学开始加热A后,发现此前操作中有一处严重的疏漏,如何补救?装置冷却后再补加数片沸石或碎瓷片.
(4)步骤④中加入无水MgSO4是为了除去某种杂质,如何检验该杂质是否除尽?简述实验方法:取出部分产物,往其中中加入少量无水硫酸铜,若不变蓝,表明水已除尽.
(5)步骤⑤中,若温度计水银球的位置过高,则所收集馏分的沸点高于(填“高于”或“低于”)目标产物的沸点.
(6)本实验的产率是d(填标号). a.30% b.40% c.50% d.60%
13.苯甲酸广泛应用于制药和化工行业.某同学尝试用甲苯的氧化反应制备苯甲酸.
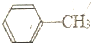 =2KMnO4$\stackrel{△}{→}$
=2KMnO4$\stackrel{△}{→}$ +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
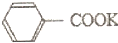 +HCl→
+HCl→ +KCl
+KCl
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
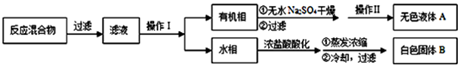
已知:苯甲酸相对分分子质量122,熔点122.4℃,在25℃和95℃时溶解度度分别为0,.3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作I为分液,操作II为蒸馏.
(2)无色液体A是甲苯,定性区分苯和A的试剂常采用酸性高锰酸钾溶液,现象是紫色溶液褪色.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔.该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表
明推测正确.请完成表中内容.
(4)纯度测定:称取1.220g产品,配成100mL甲醇溶液,移取25.00mL溶液,滴定,消耗KOH大的物质的量为2.40×10-3mol.产品中苯甲酸质量分数的计算表达为$\frac{2.4×1{0}^{-3}×4×122g/mol}{1.22g}×100%$,计算结果为96%(保留二位有效数字).
 =2KMnO4$\stackrel{△}{→}$
=2KMnO4$\stackrel{△}{→}$ +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O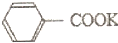 +HCl→
+HCl→ +KCl
+KCl实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.

已知:苯甲酸相对分分子质量122,熔点122.4℃,在25℃和95℃时溶解度度分别为0,.3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作I为分液,操作II为蒸馏.
(2)无色液体A是甲苯,定性区分苯和A的试剂常采用酸性高锰酸钾溶液,现象是紫色溶液褪色.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔.该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表
明推测正确.请完成表中内容.
| 序号 | 实验方案 | 试验现象 | 结论 |
| ① | 将白色固体B加入水中,加热 溶解,冷却过滤 | 得到白色晶体和无色滤液 | |
| ② | 取少量滤液于试管中, 滴入适量的硝酸酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,加热使其熔化, 测得熔点 | 测得熔点为122.4℃ | 白色晶体是苯甲酸 |
10.下列应用或事实与胶体的性质没有关系的是( )
| A. | 用明矾净化饮用水 | |
| B. | 放电影时,放映室射到银幕上的光柱 | |
| C. | 氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 | |
| D. | 滚滚长江流入大海处,形成长江三角沙洲 |
17.学生做化学实验时必须注意安全,下列说法不正确的是( )
| A. | 实验剩余的药品不能放回原试剂瓶 | |
| B. | 气体实验装置在实验前进行气密性检查 | |
| C. | 滴管不能交叉使用 | |
| D. | 如果少量酒精失火燃烧,可用湿抹布盖灭火焰 |
15.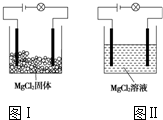 某化学兴趣小组进行化学实验,按照图Ⅰ连接好线路发现灯泡不亮,按照图Ⅱ连接好线路发现灯泡亮,由此得出的结论正确的是( )
某化学兴趣小组进行化学实验,按照图Ⅰ连接好线路发现灯泡不亮,按照图Ⅱ连接好线路发现灯泡亮,由此得出的结论正确的是( )
 某化学兴趣小组进行化学实验,按照图Ⅰ连接好线路发现灯泡不亮,按照图Ⅱ连接好线路发现灯泡亮,由此得出的结论正确的是( )
某化学兴趣小组进行化学实验,按照图Ⅰ连接好线路发现灯泡不亮,按照图Ⅱ连接好线路发现灯泡亮,由此得出的结论正确的是( )| A. | MgCl2是非电解 | |
| B. | MgCl2溶液是电解质 | |
| C. | MgCl2在水溶液中电离出了可以自由移动的离子 | |
| D. | MgCl2只有在溶液中才能导电 |