题目内容
【题目】磷酸是重要的化学试剂和工业原料。请回答下列问题:
(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
物质 | H3PO4 | HF |
电离常数 | Ka1=7.1×103; Ka2=6.3×108; Ka3=4.2×1013 | Ka=6.6×104 |
向NaF溶液中滴加少量H3PO4溶液,反应的离子方程式为____________
(2)已知:
Ⅰ.CaO(s)+H2SO4(l)![]() CaSO4(s)+H2O(l) ΔH=-271kJ·mol1
CaSO4(s)+H2O(l) ΔH=-271kJ·mol1
Ⅱ.5CaO(s)+3H3PO4(l)+HF(g)![]() Ca5(PO4)3F(s)+5H2O(l) ΔH=-937kJ·mol1
Ca5(PO4)3F(s)+5H2O(l) ΔH=-937kJ·mol1
则:①工业上用Ca5(PO4)3F和硫酸反应制备磷酸的热化学方程式为____________。
②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率________(填“增大”“减小”或“不变”,下同);HF的平衡浓度________。
(3)工业上用磷尾矿制备Ca5(PO4)3F时生成的副产物CO可用于制备H2,原理为CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH。
CO2(g)+H2(g) ΔH。
①一定温度下,向10L密闭容器中充入0.5mol CO和1mol H2O(g),2min达到平衡时,测得0~2min内用CO2表示的反应速率v(CO2)=0.02mol·L1·min1。则CO的平衡转化率α=________;该反应的平衡常数K=________。
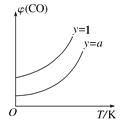
②在压强不变的密闭容器中发生上述反应,设起始的![]() =y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH___0(填“>”“<”或“=”,下同)。a_____1,理由为_____________
=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH___0(填“>”“<”或“=”,下同)。a_____1,理由为_____________
【答案】H3PO4+F-=HF+H2PO4- Ca5(PO4)3F(s)+5H2SO4(l)![]() 3H3PO4(l)+HF(g)+5CaSO4(s) ΔH=-418 kJ·mol-1 增大 不变 80%
3H3PO4(l)+HF(g)+5CaSO4(s) ΔH=-418 kJ·mol-1 增大 不变 80% ![]() < < 相同温度下,y越小,CO的转化率越大,其平衡体积分数越小
< < 相同温度下,y越小,CO的转化率越大,其平衡体积分数越小
【解析】
(1)根据电离平衡常数可知酸性有如下关系:H3PO4>HF>H2PO4->HPO42-,所以向NaF溶液中滴加少量H3PO4溶液,反应的离子方程式为为:H3PO4+F-=HF+H2PO4-;
(2)①已知:Ⅰ.CaO(s)+H2SO4(l)![]() CaSO4(s)+H2O(l) ΔH=-271 kJ·mol-1
CaSO4(s)+H2O(l) ΔH=-271 kJ·mol-1
Ⅱ.5CaO(s)+3H3PO4(l)+HF(g)![]() Ca5(PO4)3F(s)+5H2O(l) ΔH=-937 kJ·mol-1
Ca5(PO4)3F(s)+5H2O(l) ΔH=-937 kJ·mol-1
根据盖斯定律可知Ⅰ×5-Ⅱ即得到Ca5(PO4)3F和硫酸反应制备磷酸的热化学方程式为Ca5(PO4)3F(s)+5H2SO4(l)![]() 3H3PO4(l)+HF(g)+5CaSO4(s) ΔH=-418 kJ·mol-1;
3H3PO4(l)+HF(g)+5CaSO4(s) ΔH=-418 kJ·mol-1;
②反应Ⅱ的正反应体积减小,所以达到平衡后缩小容器容积平衡向正反应方向移动,HF的平衡转化率增大。由于温度不变,平衡常数不变,即K=c(HF),因此HF的平衡浓度不变;
(3)①测得 0~2 min内用CO2表示的反应速率v(CO2)=0.02 mol·L-1·min-1,所以生成CO2浓度是0.04mol/L,则

因此CO的平衡转化率α=![]() ×100%=80%,该反应的平衡常数K=
×100%=80%,该反应的平衡常数K=![]() =
=![]() ;
;
②根据图像可知升高温度CO的体积分数增大,说明平衡向逆反应方向进行,所以该反应的ΔH<0,由于相同温度下,y越小,CO的转化率越大,其平衡体积分数越小,所以a<1。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案