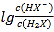题目内容
【题目】化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是______(填字母)。
A.Na2O与水反应 B.甲烷的燃烧反应 C.CaCO3受热分解 D.锌与盐酸反应
(2)获取能量变化的途径
① 通过化学键的键能计算。已知:
化学键种类 | H—H | O=O | O—H |
键能(kJ/mol) | 436 | 498 | 463.4 |
计算可得:2H2(g)+ O2(g) =2H2O(g) H=____________kJ·mol-1
② 通过物质所含能量计算。已知反应中A+B=C+D中A、B、C、D所含能量依次可表示为E A、EB、 EC、 ED,该反应△H=_______。
③ 通过盖斯定律可计算。已知在25℃、101kPa时:
Ⅰ.2Na(s)+![]() O2 (g) =Na2O(s) △H=-414kJ·mol-1
O2 (g) =Na2O(s) △H=-414kJ·mol-1
Ⅱ.2Na(s)+O2(g) =Na2O2(s) △H=-511kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式__________。
④利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50 mL 0.50 mol·L-1的盐酸,则还需加入________(填序号)。
A.50 mL 0.50 mol·L-1 NaOH溶液
B.50 mL 0.55 mol·L-1NaOH溶液
C.1.0 g NaOH固体
【答案】C -483.6 EC+ ED—(EA+EB) Na2O2(s)+2Na(s)====2Na2O(s)△H=-317 kJ·mol-1 B
【解析】
考查反应热的计算。根据△H=断键键能总和-成键键能总和或者△H=生成物总能量-反应物总能量进行解答;
(1)A.Na2O与水反应 属于放热反应,故A不符合;
B.甲烷的燃烧反应属于放热反应,故B不符合;
C.CaCO3受热分解属于吸热反应,故C符合;
D.锌与盐酸反应属于放热反应,故D不符合;
所以,属于吸热反应的是C;
(2)①根据2H2(g)+ O2(g) =2H2O(g)方程式可知,△H=断键键能总和-成键键能总和,即H=2H—H+ O=O- 4O—H =2×436+498-463.4×4=-483.6 kJ·mol-1;
② 通过物质所含能量计算△H=生成物总能量-反应物总能量。所以反应A+B=C+D中△H= EC+ED-(EA+EB);
③ 通过盖斯定律可I×2-II:2Na(s)+ Na2O2(s)= 2Na2O(s) △H =-414kJ·mol-1×2-(-511kJ·mol-1)=-317 kJ·mol-1;所以Na2O2与Na反应生成Na2O的热化学方程式为:Na2O2(s)+2Na(s) ==2Na2O(s) △H=-317 kJ·mol-1;
④测量盐酸与NaOH溶液反应的热量变化的过程中,为了保证酸或是碱中的一方完全反应,往往保证一方过量,所以若取50 mL 0.50 mol·L-1的盐酸,还需加入50 mL 0.55 mol·L-1NaOH溶液;因此,本题正确答案是:B。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案