题目内容
【题目】科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为______。
(2)下列关于CH4和CO2的说法正确的是______(填序号)。
a.固态CO2属于分子晶体
b. CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni原子的电子排布式为____________,Ni该元素位于元素周期表的第___族。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有_____molσ键。
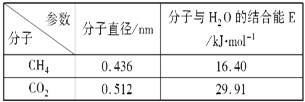
(4)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”。
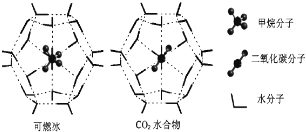
①“可燃冰”中分子间存在的2种作用力是______。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是___________________________。
【答案】 H<C<O ad [Ar]3d84s2 VⅢ 8 氢键,范德华力 二氧化碳的分子直径小于笼状结构的空腔直径,且二氧化碳与水的结合能力强于甲烷
【解析】(1)元素的非金属性越强,其电负性就越大。在CH4和CO2所含的H、C、O三种元素中,元素的非金属性由强到弱的顺序是O>C>H,所以元素的电负性从小到大的顺序为H<C<O;(2)a.固态CO2是由CO2分子通过分子间作用力结合形成的分子晶体,正确。B.在CH4分子中含有不同种非金属元素形成的C-H极性共价键,由于该分子中各个共价键空间排列对称,该分子是正四面体型的结构的分子,因此该反应是非极性分子,错误。c.CH4和CO2都是由分子构成的分子晶体,分子之间通过分子间作用力结合,分子间作用力越强,物质的熔、沸点就越高,物质的熔沸点高低与分子内的化学键的强弱无关,错误。d.CH4分子中碳原子形成的都是σ键,碳原子的杂化类型是sp3的杂化,而CO2分子中C原子与两个氧原子个形成了四个共价键,两个σ键,两个π键,碳原子的杂化类型是sp杂化,正确。故答案选a、d;(3)①28号元素Ni的基态原子的电子排布式为1s22s22p63s23p63d84s2或[Ar] 3d84s2;,该元素位于元素周期表的第四周期第VIII族。②Ni能与CO形成正四面体形的配合物Ni(CO)4,在每个配位体中含有一个σ键,在每个配位体与中心原子之间形成一个σ键,所以1mol Ni(CO)4中含有8molσ键。(4)①“可燃冰”中分子间存在的2种作用力是分子间作用力和氢键,分子间作用力也叫范德华力。②根据表格数据可知,笼状空腔的直径是0. 586nm,而CO2分子的直径是0. 512nm,大于分子的直径,而且CO2与水分子之间的结合力大于CH4,因此可以实现用CO2置换CH4的设想。

 名校课堂系列答案
名校课堂系列答案



