题目内容
【题目】SO2是大气中的有害物质,需要对其进行综合治理和利用。
(1)工业上常用氨水吸收法处理SO2,可生成(NH4)2SO3或NH4HSO3。
① (NH4)2SO3显碱性,用化学平衡原理解释其原因:____________。
② NH4HSO3显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是____(填字母)。
a.c(NH4+)=2c(SO32-)+c(HSO3-)
b.c(NH4+)>c(SO32-)> c(H+)=c(OH-)
c.c(NH4+)+c(H+)=c(SO32-) +c(HSO3-)+c(OH-)
(2)某工厂烟气中主要含SO2、CO2,在较高温度经下图所示方法脱除SO2,可制得H2SO4。

①在阴极放电的物质是_______。
②在阳极生成SO3的电极反应式是______。
(2)检测烟气中SO2脱除率的步骤如下:
a.将一定量的净化气(不含SO3)通入足量NaOH溶液后,再加入足量溴水。
b.加入浓盐酸,加热溶液至无色无气泡,再加入足量BaCl2溶液。
c.过滤、洗涤、干燥,称量沉淀质量。
①用离子方程式表示a中溴水的主要作用________________。
②若沉淀的质量越大,说明SO2的脱除率越_____(填“高”或“低”)。
【答案】溶液中存在平衡:NH4+ +H2O![]() NH3·H2O + H+ ,SO32-+H2O
NH3·H2O + H+ ,SO32-+H2O![]() HSO3-+ OH-,SO32-水解程度大于NH4+ 水解程度使溶液中c(OH-) > c(H+),所以溶液显碱性。 ab O2 2SO42--4e-= 2SO3↑+O2 ↑ SO32-+Br2+H2O=SO42-+2Br-+ 2H+或SO32-+Br2+2OH-====SO42-+2Br-+H2O 低
HSO3-+ OH-,SO32-水解程度大于NH4+ 水解程度使溶液中c(OH-) > c(H+),所以溶液显碱性。 ab O2 2SO42--4e-= 2SO3↑+O2 ↑ SO32-+Br2+H2O=SO42-+2Br-+ 2H+或SO32-+Br2+2OH-====SO42-+2Br-+H2O 低
【解析】
(1)根据水解原理,电荷守恒进行分析;(2)由图分析是由SO2-O2-H2SO4形成的燃料电池,通O2的电极为正极,发生还原反应,通SO2的电极为负极,发生氧化反应转化为H2SO4,根据电解质溶液是酸性的,写出负极反应式;阳离子在电解质溶液中由负极移动到正极,据此解答即可;
①(NH4)2SO3溶液中,铵根和亚硫酸根都会水解,NH4+ +H2O![]() NH3·H2O + H+ ,SO32-+H2O
NH3·H2O + H+ ,SO32-+H2O![]() HSO3-+ OH-,(NH4)2SO3显碱性说明SO32-水解程度大于NH4+的水解程度,使溶液中c(OH-)>c(H+ ),所以溶液呈碱性;因此,本题正确答案是: 溶液中存在平衡:NH4+ +H2O
HSO3-+ OH-,(NH4)2SO3显碱性说明SO32-水解程度大于NH4+的水解程度,使溶液中c(OH-)>c(H+ ),所以溶液呈碱性;因此,本题正确答案是: 溶液中存在平衡:NH4+ +H2O![]() NH3·H2O + H+ ,SO32-+H2O
NH3·H2O + H+ ,SO32-+H2O![]() HSO3-+ OH-,SO32-水解程度大于NH4+ 水解程度使溶液中c(OH-) > c(H+),所以溶液显碱性;
HSO3-+ OH-,SO32-水解程度大于NH4+ 水解程度使溶液中c(OH-) > c(H+),所以溶液显碱性;
②据电荷守恒有: c(NH4+)+c(H+)=2c(SO32-) +c(HSO3-)+c(OH-),溶液显中性,则 c(H+)=c(OH-),所以c(NH4+)=2c(SO32-)+c(HSO3-),故a正确,b正确,c错误;
(3)①依据题意得出SO2-O2-H2SO4形成的燃料电池中可知,氧气在原电池的正极得到电子发生还原反应,故答案为:O2;
②熔融硫酸钾中硫酸根失去电子,在原电池的负极放电,电极反应方程式为:2SO42--4e-= 2SO3↑+ O2 ↑;
(2)①溴水具有强氧化性,亚硫酸根具有还原性,所以不含SO3的净化气通入足量NaOH溶液后,再加入足量溴水反应方程式为:SO2+2OH-=SO32-+H2O,SO32-+Br2+H2O=SO42-+2Br-+2H+,故答案为:SO2+2OH-=SO32-+H2O,SO32-+Br2+H2O=SO42-+2Br-+2H+;或SO32-+Br2+2OH-=SO42-+2Br-+H2O ;
②生成沉淀越多,说明烟气中二氧化硫含量越高,脱除率越低。

 阅读快车系列答案
阅读快车系列答案【题目】化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是______(填字母)。
A.Na2O与水反应 B.甲烷的燃烧反应 C.CaCO3受热分解 D.锌与盐酸反应
(2)获取能量变化的途径
① 通过化学键的键能计算。已知:
化学键种类 | H—H | O=O | O—H |
键能(kJ/mol) | 436 | 498 | 463.4 |
计算可得:2H2(g)+ O2(g) =2H2O(g) H=____________kJ·mol-1
② 通过物质所含能量计算。已知反应中A+B=C+D中A、B、C、D所含能量依次可表示为E A、EB、 EC、 ED,该反应△H=_______。
③ 通过盖斯定律可计算。已知在25℃、101kPa时:
Ⅰ.2Na(s)+![]() O2 (g) =Na2O(s) △H=-414kJ·mol-1
O2 (g) =Na2O(s) △H=-414kJ·mol-1
Ⅱ.2Na(s)+O2(g) =Na2O2(s) △H=-511kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式__________。
④利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50 mL 0.50 mol·L-1的盐酸,则还需加入________(填序号)。
A.50 mL 0.50 mol·L-1 NaOH溶液
B.50 mL 0.55 mol·L-1NaOH溶液
C.1.0 g NaOH固体
【题目】氧化白藜芦醇W具有抗病毒等作用。下面是利用Heck反应合成W的一种方法:
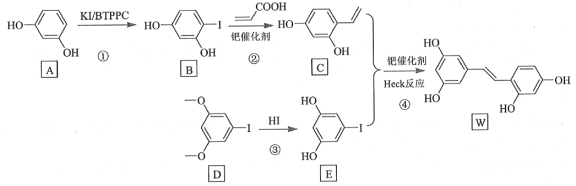
回答下列问题:
(1)A的化学名称为___________。
(2)![]() 中的官能团名称是___________。
中的官能团名称是___________。
(3)反应③的类型为___________,W的分子式为___________。
(4)不同条件对反应④产率的影响见下表:
实验 | 碱 | 溶剂 | 催化剂 | 产率/% |
1 | KOH | DMF | Pd(OAc)2 | 22.3 |
2 | K2CO3 | DMF | Pd(OAc)2 | 10.5 |
3 | Et3N | DMF | Pd(OAc)2 | 12.4 |
4 | 六氢吡啶 | DMF | Pd(OAc)2 | 31.2 |
5 | 六氢吡啶 | DMA | Pd(OAc)2 | 38.6 |
6 | 六氢吡啶 | NMP | Pd(OAc)2 | 24.5 |
上述实验探究了________和________对反应产率的影响。此外,还可以进一步探究________等对反应产率的影响。
(5)X为D的同分异构体,写出满足如下条件的X的结构简式________________。
①含有苯环;②有三种不同化学环境的氢,个数比为6∶2∶1;③1 mol的X与足量金属Na反应可生成2 g H2。
(6)利用Heck反应,由苯和溴乙烷为原料制备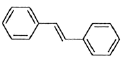 ,写出合成路线________________。(无机试剂任选)
,写出合成路线________________。(无机试剂任选)