题目内容
【题目】某化学兴趣小组的同学利用图1所示实验装置进行NH3的制备、性质等实验. 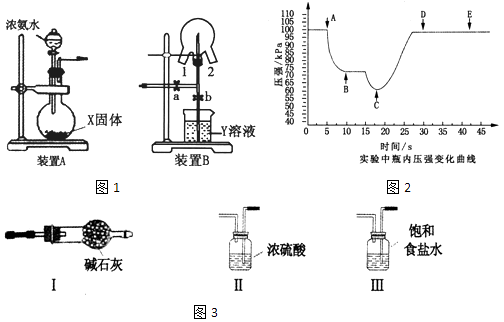
(1)装置A中的烧瓶内的X固体宜选用(填序号).
a.消石灰 b.氯化钙 c.五氧化二磷 d.生石灰
烧瓶中制取NH3的化学方程式为 .
(2)为制取干燥的氨气,可将装置A与下列装置如图3(填序号)进行连接.
(3)装置B可用于探究氯气与氨气的反应.实验时先通过三颈瓶瓶口1通入氨气,然后关闭b活塞,再通过瓶口2通入氯气.
①实验中三颈瓶内出现白烟并在内壁凝结成固体,发生反应的化学方程式为 , 请设计一个实验方案鉴定该固体中的阳离子;
②实验完毕后,观察到三颈瓶内还有黄绿色气体,简述如何处理才能不污染环境 .
(4)可用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理:装置A与装置B相连,打开a,关闭b,开始实验,使三颈瓶内充满NH3 . 将吸有2mL H2O的胶头滴管塞进颈口1,通过颈口2将数据采集器的探头插入三颈瓶中.打开b,关闭a,挤压胶头滴管,进行喷泉实验,电脑绘制三颈瓶内气压变化曲线如图2.该图中点时喷泉最剧烈.
【答案】
(1)d;NH3?H2O+CaO=Ca(OH)2+NH3↑
(2)Ⅰ
(3)8NH3+3Cl2=6NH4Cl+N2;取少量固体于试管中,加入适量NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝,证明固体中有NH4+;将活塞b打开,氯气即被氢氧化钠溶液吸收
(4)C
【解析】解:(1)生石灰与水反应生成氢氧化钙,放出大量的热,有利于氨气的逸出,所以可以用将浓氨水逐滴滴加到生石灰上制取氨气;一水合氨与氧化钙反应生成氢氧化钙和氨气,方程式:NH3H2O+CaO=Ca(OH)2+NH3↑;所以答案是:d;NH3H2O+CaO=Ca(OH)2+NH3↑;(2)氨气为碱性气体,应选择碱性干燥剂;
碱石灰为碱性干燥剂,可以干燥氨气;
浓硫酸能够与氨气反应,不能干燥氨气;
氨气极易溶于水,所以饱和食盐水不能干燥氨气;
故选:Ⅰ;(3)①氯气与氨气的反应方程式为:3Cl2+8NH3=N2+6NH4Cl,则白烟的成分为氯化铵;铵根离子可一碱反应生成碱性气体氨气,铵根离子的检验方法是,取少量固体于试管中,加入适量NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝,证明固体中有NH4+ ,
所以答案是:3Cl2+8NH3=N2+6NH4Cl;取少量固体于试管中,加入适量NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝,证明固体中有NH4+ . ②氯气有毒不能直接排到空气 中,氯气能够与氢氧化钠反应,可用氢氧化钠吸收过量的氯气,所以正确的操作是:将活塞b打开,氯气即被氢氧化钠溶液吸收;
所以答案是:将活塞b打开,氯气即被氢氧化钠溶液吸收;(4)三颈瓶内气体与外界大气压压强之差越大,其反应速率越快,C点压强最小、大气压不变,所以大气压和C点压强差最大,则喷泉越剧烈,
所以答案是:C.
【考点精析】本题主要考查了氯气的实验室制法的相关知识点,需要掌握实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O才能正确解答此题.